时间:2017-01-16 16:37:33
1、选择题 现有物质的量浓度均为0.1 mol/L的下列5种物质的水溶液:①HNO3????②H2SO4③CH3COOH?④? NaOH其溶液中由水电离出的c(H+)的大小关系是
A.③>①=④>②
B.③=①=④>②
C.②>①>③>④
D.③>①>④>②
参考答案:A
本题解析:酸或碱都是抑制水的电离的,在浓度相同的条件下,硝酸和氢氧化钠对水的抑制程度相同。硫酸是二元强酸,抑制程度最强,醋酸是弱酸,抑制程度最弱,所以正确的答案选A。
本题难度:一般
2、填空题 现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是????????????(选填序号,下同),水的电离程度相同的是????????????;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②???③(选填“>”、“<”或“=”);
⑶将六份溶液稀释相同倍数后,溶液的pH:①????②,③????④,⑤???⑥(选填“>”、“<”或“=”);
⑷将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈?????????(填序号)
A.酸性????? B.碱性???? C.中性
参考答案:⑴⑥????②③④??⑵?>?⑶??>?>???>⑷? AB
本题解析:(1)水属于弱电解质,存在电离平衡H2O H++OH-,根据电离出的离子可知酸或碱是抑制水的电离,而盐类的水解则是促进水的电离。pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以⑤中氨水是过量的,所以溶液显碱性。在⑥中二者恰好反应生成氯化钠,氯化钠是不能发生水解的,所以在该溶液中水的电离没有被抑制,而在
H++OH-,根据电离出的离子可知酸或碱是抑制水的电离,而盐类的水解则是促进水的电离。pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以⑤中氨水是过量的,所以溶液显碱性。在⑥中二者恰好反应生成氯化钠,氯化钠是不能发生水解的,所以在该溶液中水的电离没有被抑制,而在
本题难度:简单
3、填空题 (14分)
(1)25 ℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为??????????????????
已知25 ℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH=10,溶液中各离子的物质的量浓度由大到小的顺序为??????????????????????????。
(2))若100 ℃时,KW=10-12,则100 ℃时pH=11的Ba(OH)2溶液与pH=2的硫酸按体积比1:9混合充分反应后pH=??????????;若该温度下10体积的pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合之前,a与b之间应满足的关系为???????? ????????????。
????????????。
(3)某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示。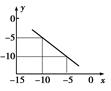
该温度下水的离子积为??????????????。该温度下氯化钠溶液的pH为????????????????
该温度下0.01 mol/L NaOH溶液的pH为????????????????。
参考答案:(14分)每空2分
(1)的体积比为? 1∶9?
本题解析:略
本题难度:一般
4、填空题 (6分)已知水在25℃和99℃时,其电离平衡曲线如右图所示:
(1)则25 时水的电离平衡曲线应为______(A或B)。
(2)25时,将=9的NaOH溶液与=4的H2SO4溶液混合,若所得混合溶液的=7,则NaOH溶液与H2SO4溶液的体积比为____________。
(3)99时,若100体积1=的某强酸溶液与1体积
2=b的某强碱溶液混合后溶液呈中性,则混合前,与b之间应满足的关系是____________________。
参考答案:(1)A??????(2)10 : 1????(3)a+b=
本题解析:略
本题难度:一般
5、选择题 下列说法正确的是?????????????????????????????????????????????????????? [???? ]
A.在101kpa下,1mol物质完全燃烧的反应热叫做该物质的热值
B.盐桥通常用含CuCl2的饱和溶液的琼脂的离子移动来平衡溶液中的电荷
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
参考答案:C
本题解析:
本题难度:简单