时间:2017-01-16 16:16:30
1、填空题 2008年9月27日的下午,这是一个激动人心的时刻,“神舟七号”宇航员翟志刚走出飞船,实现了中国太空第一步。这是我国航天史上一座新的里程碑,标志着我国在攀登世界科技高峰的征程上,又迈出了具有重大历史意义的一步。
(1)钛作为一种重要的航天金属,在“神舟七号”飞船上得到广泛的应用,工业上可用钠、镁还原钛的卤化物来制备,写出镁还原四氯化钛的化学反应方程式____________________,该反应需在氩?气气氛中进行的原因是?______________________________________。
(2)“神舟七号”飞船外壳使用了一种新型陶瓷结构材料,主要成分是氮化硅,是一种超硬物质,耐磨损、耐高温。依据氮、硅的原子结构的特点,推测氮化硅的化学式为__________。
(3)“尿不湿”最早应用于航天领域,至今已大量应用于民用领域,这种尿布表面涂有一种既能吸水又能保留水的物质。据你的推测,这种特殊物质的结构可能是________。
A.CH2=CHOOCCH3 B.CH2=CHF C.CH2=CHOH??D.CCl2=CCl2
(4)肼(N2H4)是“神舟七号”飞船助推火箭发动机的燃料,反应时以N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7?kJ/mol N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.0?kJ/mol
①肼(N2H4)的电子式为____________。
②写出肼跟N2O4反应的热化学方程式?___________________________________。
参考答案:(1)TiCl4+2Mg本题解析:
本题难度:一般
2、选择题 已知:(1)
(2)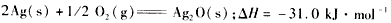
则Zn(s) +Ag2O(s)=ZnO(s) +2Ag(s)的△H等于 [???? ]
A.-317.3 kJ/mol
B.-379.3 kJ/mol
C.-332. 8 kJ/mol
D.317.3 kJ/mol
参考答案:A
本题解析:
本题难度:一般
3、填空题 已知下列热化学方程式:
(1)Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g) ΔH=-25kJ·mol-1
(2)3Fe2O3(s)+CO(g)====2Fe3O4(s)+CO2(g) ΔH=-47kJ·mol-1
(3)Fe3O4(s)+CO(g) ====3FeO(s)+CO2(g) ΔH= +19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式:_________________________________。
参考答案:FeO(s)+CO(g)==Fe(s)+CO2(g) ΔH=
本题解析:
本题难度:一般
4、简答题 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
(1)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)?设计的双液原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液.
回答下列问题:
①电极X的材料和电解质溶液Y分别为______、______;
②盐桥中K+移向______(填A或B);
③银电极发生的电极反应为______.
(2)已知:C(s)+O2(g)=CO2(g)△H1=-396.5kJ?mol-1
H2(g)+1/2O2=H2O(g)△H2=-241.8kJ?mol-1
CO(g)+1/2O2(g)=CO2(g)△H3=-283.0kJ?mol-1
根据盖斯定律写出单质碳和水蒸气生成水煤气的热化学方程式:______.
(3)100mL?1.0mol?L-1盐酸与100mL1.0mol?L-1NaOH溶液在量热计中进行中和反应.测得反应后溶液温度升高了6.8℃,已知稀溶液的比热容为4.2kJ/℃?kg-1,则该中和反应的反应热为______.(小数点后面保留一位有效数字)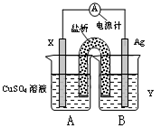
参考答案:(1)①氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+
本题解析:
本题难度:一般
5、填空题 已知下列两个反应:
a.C2H2(g)+H2(g)=C2H4(g) ΔH<0
b.2CH4(g)=C2H4(g)+2H2(g) ΔH>0
判断以下3个热化学方程式ΔH1、ΔH2、ΔH3由大到小的顺序是__________________________________。 ①C(s)+2H2(g)=CH4(g) ΔH1
②C(s)+1/2H2(g)=1/2C2H2(g) ΔH2
③C(s)+H2(g)=1/2C2H4(g) ΔH3
参考答案:
ΔH1<ΔH3<ΔH2
本题解析:
本题难度:一般