1
2
O2(g)═CO2(g)△H3=-283.0kJ/mol
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:______.
(3)在25℃下,向浓度均为0.1mol-L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20).
(4)常温下,0.l?mol-L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)______c(CO32-)(填“>”、“=”或“<”).
(5)在25℃下,将a?mol-L-1的氨水与0.01mol-L-1的盐酸等体积混合,反应完成后溶液中c(NH4+)=c(Cl-),则溶液显______性(填“酸”“碱”或“中”),a______0.01mol-L-1(填“>”、“=”或“<”).
参考答案:(1)纯水中,c(H+)=c(OH-)=2×10-7 mol
本题解析:
本题难度:一般
4、填空题 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g) 2SO3(g) 某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。 2SO3(g) 某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。
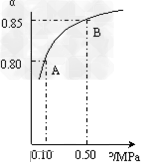
根据图示回答下列问题:
①将2.0mol?SO2和1.0mol?O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数表达式为:__________;等于____________。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)????△H=-574?kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?????△H=-1160?kJ·mol-1
若用标准状况下4.48L?CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
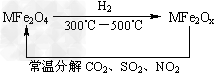
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox?3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示: 请写出MFe2Ox分解SO2的化学方程式___________(不必配平)。
参考答案:(1)①k=c2(SO3)/c(O2) c2(SO2) ;?
本题解析:
本题难度:一般
5、简答题 298K?100kPa时,NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H2=-92.2kJ?mol-1
H2(g)+Cl2(g)═2HCl(g)△H3=-184.6kJ?mol-1
298K时的N2(g)+4H2(g)+Cl2(g)═2NH4Cl(s)△H=______.
参考答案:298K?100kPa时,NH3(g)+HCl(g)═NH4
本题解析:
本题难度:一般
|