1、选择题 下列有关反应热及能量变化的说法正确的是 [???? ]
A.1mol碳燃烧生成CO时所放出的热量就是碳的燃烧热
B.从化石能源到能源的多元化,其中氢能属于不可再生能源
C.放热反应可以自发进行,而吸热反应需加热才能进行
D.应用盖斯定律,可计算某些难以直接测量的反应焓变
参考答案:D
本题解析:
本题难度:简单
2、选择题 已知反应:
H2(g)+?1/2O2(g)=H2O(g)???△H1 ?
1/2N2(g)+O2(g)=NO2(g)???△H2? ?
1/2N2(g)+3/2H2(g)=NH3(g)???△H3?
则反应2NH3(g)+?O2(g)=2NO2(g)+3H2O(g)的△H为 [???? ]
A.?2△H1+2△H2-2△H3??????
B.?△H1+△H2-△H3
C.?3△H1+2△H2+2△H3?????
D.?3△H1+2△H2-2△H3
参考答案:D
本题解析:
本题难度:一般
3、选择题 已知下列热化学方程式:
Zn(s)+
1
2
O2(g)═ZnO(s)△H1=-351.1kJ/mol
Hg(l)+1
2
O2(g)═HgO(s)△H2=-90.7kJ/mol
由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)的△H3,其中△H3的值是( )
A.-441.8 kJ/mol
B.-254.6?kJ/mol
C.-438.9?kJ/mol
D.-260.4 kJ/mol
参考答案:已知:①Zn(s)+
本题解析:
本题难度:简单
4、选择题 在298 K 100 kPa时,已知:
2H2O(g)=2H2(g)+O2(g) △H1
Cl2(g)+H2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是 [???? ]
A.△H3=△H1+2△H2
B.△H3 =△H1+△H2
C.△H3=△H1-2△H2
D.△H3=△H1-△H2
参考答案:A
本题解析:
本题难度:一般
5、简答题 为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液.
②在①的吸收液中通高温水蒸气得到高浓度的CO2气体.
写出②中反应的化学方程式______.
(2)如将CO2与H2?以1:3的体积比混合.
①适当条件下合成某烃和水,该烃是______(填序号).
A.烷烃?????B.烯烃?????C.炔烃????D.苯的同系物
②适当条件下合成燃料甲醇和水.在体积为2L的密闭容器中,充入?2mol?CO2和6mol?H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
从反应开始到平衡,v(H2)=______;氢气的转化率=______;能使平衡体系中n(CH3OH)增大的措施有______.
(3)如将CO2与H2?以1:4的体积比混合,在适当的条件下可制得CH4.已知:
CH4?(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
H2(g)+1/2O2(g)═H2O(l)△H2=-285.8kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是______.
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表.
| 溶解度(S)/g | 溶度积(Ksp)
Ca(OH)2
Ba(OH)2
CaCO3
BaCO3
0.16
3.89
2.9×10-9
2.6×10-9
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是______(填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定______.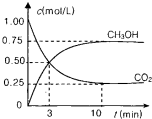
参考答案:(1)①中碳酸钾吸收二氧化碳生成碳酸氢钾,通高温水蒸气,碳酸
本题解析:
本题难度:一般
|
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
|
|