时间:2017-01-16 15:40:32
1、实验题 某研究小组进行与NH3有关的系列实验。
(1)从下图中挑选所需仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。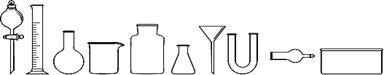
(2)将NH3通入溴水中,有N2生成,反应的化学方程式为????????????????????。
2、实验题 (14分)三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 硝酸、1.0 mol·L-1 盐酸、1.0 mol·L-1 NaOH溶液、3% H2O2、0.1 mol·L-1 KI溶液、0.1 mol·L-1 CuSO4溶液、20% KSCN溶液、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过(A)澄清石灰水、浓氢氧化钠?(B)浓硫酸、灼热氧化铜??(C)澄清石灰水;观察到(A)、(C)中澄清石灰水都变浑浊,(B)中有红色固体生成,则气体产物是????????????。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是???????????。
(3)固体产物中铁元素存在形式的探究。
① 提出合理假设
假设1:?????????????????????????????;
假设2:?????????????????????????????;
假设3:?????????????????????????????。
② 设计实验方案证明你的假设
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 | 固体部分溶解。 |
| 步骤2: | ? |
| 步骤3: | ? |
| ? | ? ??(4)若假设1成立,K3[Fe(C2O4)3]分解反应的化学方程式为????????????????。 3、填空题 为探索工业废料的再利用,某化学兴趣小组设计了如图-5实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。 4、实验题 (12分)为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验: 5、选择题 研究有机物一般经过以下几个基本步骤:分离、提纯→ 确定实验式→ 确定分子式→ 确定结构式以下用于研究有机物的方法错误的是 [???? ] |