时间:2017-01-15 17:54:59
1、选择题 已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) ??△H= +255.6kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)==3H2(g)+2CO(g)??△H= +13.8kJ·mol-1
则下列说法不正确的是??????????????
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ·mol-1
参考答案:A
本题解析:
试题分析:A选项降低温度,会降低b路线中乙醇的转化率。B选项由于b反应发生时需要吸收的热量少,所以从能量消耗的角度来看,b路线制氢更加有利,B正确。C乙醇可通过淀粉等生物原料发酵制得,属于可再生资源,C正确。D选项可以由盖斯定律来计算,要得到2H2(g)+O2(g)=2H2O(g),需用—b—2a,所以△H=—13.8kJ·mol-1—2×255.6kJ·mol-1= 483.6kJ·mol-1故D正确。
点评:本题从两个热化学方程式出发,考察了转化率,盖斯定律的相关知识,体现了各个知识点的
本题难度:一般
2、实验题 100ml0.50mol·L-1盐酸与100mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: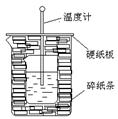
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是????????????????????????
(2)烧杯间填满碎纸条的作用是???????????????????????????????????。
(3)实验中若改用110mL0.50mol·L-1盐酸跟100mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量??????(填“相等”或“不相等”),所求中和热????????(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会???????;(填“偏大”“偏小”或“无影响”)。
(5)在量热计中将22.3℃、100ml 1.0mol/L的盐酸与等体积等温度的1.00mol/L的氢氧化钠溶液混合,温度最高升高到29.00℃。已知量热计的热容是46.1J/K,此条件下的NaCl溶液的比热容为4.03J/(g.K),溶液的密度为1.02g/ml,试计算生成每摩NaCl的
反应热(直接写答案)??????????????KJ/mol。
参考答案:(1)环形玻璃搅拌棒(2)减少实验过程中的热量损失(3)不相
本题解析:考查中和热的测定。实验中需要搅拌,所以还缺少环形玻璃搅拌棒。
(2)实验过程中需要尽可能的减少热量损失,所以碎纸条的作用是减少实验过程中的热量损失。
(3)由于反应中生成的水不同,所以放出的热量不同。但中和热是不变的,因为中和热是指在一定条件下的稀溶液中,酸和碱反应生成1mol水时放出的热量。
(4)氨水中存在电离平衡,电离吸热,所以测定结果偏小。
(5)根据题意反应中放出的热量是4.03×6.7×200×1.02+6.7×46.1=5817.074J=5.82kJ
所以反应
本题难度:一般
3、选择题 下列说法正确的是
[???? ]
参考答案:B
本题解析:
本题难度:简单
4、选择题 分析右图的能量变化示意图,下列选项正确的是( )
A.2A+B═2C;△H<O
B.2C═2A+B;△H<0
C.2A(g)+B(g)═2C(g)△H>0
D.2A(g)+B(g)═2C(g)△H<0
参考答案:由图象知,2A+B的能量小于2C的能量,根据化学反应前后能量
本题解析:
本题难度:一般
5、选择题 下列设备工作时,将化学能转化为热能的是( )
A.
硅太阳能电池
B.
锂离子电池
C.
太阳能集热器
D.
燃气灶
参考答案:A.硅太阳能电池是太阳能转化为电能,故A错误;
B.
本题解析:
本题难度:一般