时间:2017-01-15 17:54:59
1、选择题 下列说法正确的是?????????????????????
A.只有反应体系中所有分子同时都发生有效碰撞的反应才是放热反应
B.通常条件下能够自发进行的反应必须具备△H和△S均大于0
C.任何化学反应只要是自发进行的放热反应都可以设计成原电池,为外界提供电能
D.实验室通常将固态氯化铁溶解在盐酸中,再稀释到相应浓度来配置氯化铁溶液
参考答案:D
本题解析:A 错误,只要是生成物的总能量低于反应物的总能量,即为放热反应。
B 错误,△G=△H-T△S<0,即为自发进行的反应。
C 错误,必须是自发进行的氧化还原反应,才可以设计成原电池。
D 正确,配置氯化铁溶液,为了抑制三价铁离子水解,通常将固态氯化铁溶解在盐酸中,再稀释到相应浓度。
本题难度:一般
2、填空题 (Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。 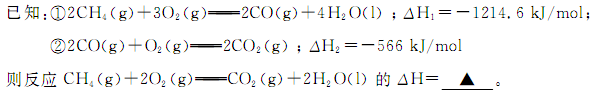
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是:???????????????????????????。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应: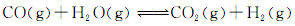 ,得到如下三组数据:
,得到如下三组数据: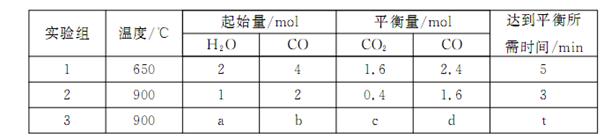
①实验1中,以v( H2)表示的平均反应速率为:?????。
②该反应的正反应为?????(填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是 ??????(用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。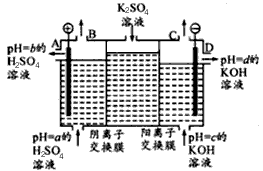
①该电解槽中通过阴离子交换膜的离子数??????(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ?????????????;
③电解一段时间后,B出口与C出口产生气体的质量比为?????????????。
参考答案:(Ⅰ)(1) -890.3 kJ/mol??(2分)
本题解析:
试题分析:(1)将两个方程式相加再除以2即得所求的反应,故所求反应的ΔH=(ΔH1+ΔH2)/2,带入数值可得ΔH=-890.3 kJ/mol;(2)原电池中负极发生氧化反应,故通入甲烷的一极为负极,甲烷失去电子,在碱性条件下生成碳酸根离子;(3)①根据表格中的CO的起始量和平衡量可得转化量为1.6mol,生成氢气的物质的量为1.6mol,浓度变化量为0.8mol/L,再除以时间5分钟可得0.16 mol·L-1·min-1②温度升高,CO的转化率减小,说明升高温度平衡向左移动,故正反应为放热反应
本题难度:一般
3、填空题 (14分)运用化学反应原理分析解答以下问题
(1)已知:?①CO(g)+2H2(g)? ?CH3OH(g)??????????????△Hl= -91kJ·mol-l
?CH3OH(g)??????????????△Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g)?△H2= -24 kJ·mol-l????????????????③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g)?△H2= -24 kJ·mol-l????????????????③CO(g) +H2O(g)  ?CO2(g)+H2(g)???????△H3= -41 kJ·mol-l
?CO2(g)+H2(g)???????△H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3 ????则反应 3CO(g) +3H2(g)?????? CH3OCH3(g) +CO2(g)?△H=???????????????.
????则反应 3CO(g) +3H2(g)?????? CH3OCH3(g) +CO2(g)?△H=???????????????.
化学平衡常数K=????????(用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应 ???????? 3CO(g) +3H2(g)????? CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是?????????。
???????? 3CO(g) +3H2(g)????? CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是?????????。
a.体系压强保持不变??? B.混合气体密度保持不变
c. CO和H2的物质的量保持不变?????? d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数?????????????.
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2 = 2N2+6H2O,电解质溶液应显???????????(填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式????????????????.
参考答案:(每空2分,共14分)
(1)-247KJ·mol-
本题解析:
试题分析:(1)根据盖斯定律得3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)?△H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
CH3OCH3(g) +CO2(g)?△H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
(2)a、容器体积固定,3CO(g) +3H2(g)本题难度:一般
4、选择题 已知298K、101kPa条件下:
①4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9kJ?mol-1
②4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.1kJ?mol-1
由此得出的正确结论是( )
A.等质量的O2比O3能量低,由O2变为O3为放热反应
B.O3比O2稳定,由O2变为O3为吸热反应
C.O2比O3稳定,由O2变为O3为放热反应
D.等质量的O2比O3能量低,由O2变为O3为吸热反应
参考答案:已知25℃、101kpa条件下:
(1)4AI(s)+
本题解析:
本题难度:简单
5、选择题 已知热化学反应方程式:
Zn(s)+1/2O2(g) ZnO(s);ΔH="-351.5" kJ·mol-1
ZnO(s);ΔH="-351.5" kJ·mol-1
Hg(l)+ 1/2O2(g)  HgO(s);ΔH="-90.84" kJ·mol-1
HgO(s);ΔH="-90.84" kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)  ZnO(s)+Hg(l)的ΔH为
ZnO(s)+Hg(l)的ΔH为
A.ΔH="+260.7" kJ·mol-1
B.ΔH="-260.7" kJ·mol-1
C.ΔH="-444.2" kJ·mol-1
D.ΔH="+444.2" kJ·mol-1
参考答案:B
本题解析:略
本题难度:一般