时间:2017-01-15 17:49:43
1、选择题 下列有关结论正确的是
A.T℃时,Ba(OH)2溶液中c(H+)·c(OH-)=10-12,向pH=8的该溶液加入等体积pH=4的盐酸,则混合液pH=7
B.pH相等的硫酸、盐酸、醋酸,都稀释1000倍,稀释后pH最大的是醋酸
C.0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液在常温时pH一定小于7
D.在0.1mol/L的硫酸氢铵溶液中各离子浓度关系是:c(H+)>c(SO42-)>c(NH4+)>c(OH-)
参考答案:D
本题解析:
试题分析:T℃时,Ba(OH)2溶液中c(H+)·c(OH-)=10-12,则此时水的离子积常数应该是10-12。pH=8的该溶液中OH-的浓度是10-4mol/L,所以和盐酸恰好反应,溶液的pH=6,A不正确;醋酸是弱酸,存在电离平衡,稀释促进电离,则pH相等的硫酸、盐酸、醋酸,都稀释1000倍,稀释后pH最小的是醋酸,B不正确;0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合后,不能确定溶液的酸碱性,则选项C不正确,因此答案选D。
点评:该题水高考中常见的题型,属于中
本题难度:简单
2、选择题 pH=3的两种一元酸HX和HY溶液,分别取50mL加入足量的镁粉,充分反应后,收集到H2的体积分别为V(HX)和V(HY),若V(HX)>V(HY),则下列说法正确的是
A.HX可能是强酸
B.HY一定是强酸
C.HX的酸性强于HY的酸性
D.反应开始时二者生成H2的速率相等
参考答案:D
本题解析:在pH=3的两种一元酸HX和HY溶液,分别取50mL加入足量的镁粉,收集到H2的体积V(HX)>V(HY),即可知HX的酸性比HY酸性弱;
A错,HX一定为弱酸;B错,只能知道HY的酸性大于HX的酸性;C错,HX的酸性弱于HY的酸性;D正确,反应开始时,溶液中的氢离子浓度相等,反应速率相同;
本题难度:简单
3、选择题 取浓度相同的Na0H和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为???????????????????????????????????????????????(????)
A.0.01mol/L
B.0.017mol/L
C.0.05mol/L
D.0.50mol/L
参考答案:C
本题解析:考查pH的有关计算。根据题意氢氧化钠过量,反应后溶液中OH-的浓度为0.01mol/L。所以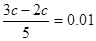 ,解得c=0.05mol/L。答案是C。
,解得c=0.05mol/L。答案是C。
本题难度:简单
4、选择题 下列叙述正确的是
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.氢能具有的优点是原料来源广、热值高、储存方便、制备工艺廉价易行
C.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
D.用聚苯乙烯全面代替木材,生产包装盒、快餐盒等以减少木材使用,保护森林
参考答案:C
本题解析:略
本题难度:一般
5、计算题 (16分)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH值的变化关系如右图所示。
(1) a >7.0的理由是(用离子方程式表示)
?????????????????????????????????????
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值
刚好为7.0。此时溶液中c(Cl-)??????c(CH3COOH)
(填<、>或=)。简要写出判断依据??????????????????????????
?????????????????????????????????????????????????????????????????????。
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 ?mol/L,求CH3COOH的电离平衡常数Ka(设混合后的体积为二者的体积之和,计算结果保留两位有效数字)。
参考答案:(16分)
(1)CH3COO- + H2O
本题解析:略
本题难度:一般