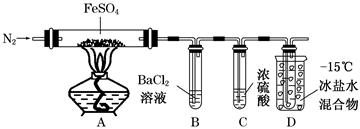
?
?????回答下列问题:
(3)上表所列实验中的“待测数据”指????????????????
(4)量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是
??????????????(填“酸式”或“碱式”)滴定管。
(5)若要证明实验Ⅱ中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住装置B中的乳胶管a,拔去干燥管上单孔橡皮塞,??????????????????????????????
(6)为探究CuO在实验Ⅱ中是否为催化剂,需补做如下实验(无需写出具体操作):
a.?????????????????????????????????,b.检验CuO的化学性质有没有改变。
3、填空题 (16分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:

(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 ==6SO2+Fe3O4,氧化产物为??????,若有3 mol FeS2参加反应, ==6SO2+Fe3O4,氧化产物为??????,若有3 mol FeS2参加反应,
转移???????mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为????????????。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为????????????(用离子方程表示)?
(4)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式????????。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为????。
4、选择题 有下列操作,对实验现象的描述,或由现象作出的判断错误的是( )
A.向溶解有Na2O2的水溶液中滴入2滴酚酞试液,溶液先变红振荡后褪色
B.向紫红色的酸性KMnO4溶液滴入足量的Na2SO3溶液,溶液紫红色褪去
C.向FeCl2溶液中滴入NaOH溶液,生成白色沉淀立即变灰绿色、最后变为红棕色
D.向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成,则说明原溶液中含SO42-
5、填空题 铁单质及其化合物在生活、生产中应用广泛。请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是???????????????。
(2)由于氧化性Fe3+>Cu2+氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是???????????????????????????????????????。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是?????????????????(用离子方程式表示)。在使用时发现硫酸铁不能将酸性废水中的悬浮物沉降除去,其原因是??????????????????。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4十4CO 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是????????????。 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是????????????。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是??????(填字母)。
?
| 陈述Ⅰ
| 陈述Ⅱ
| 判断
| A
| 铁是地壳中含量最高的金属元素
| 铁是人类最早使用的金属材料
| Ⅰ对;Ⅱ对;有
| B
| 常温下铁与稀硫酸反应生成氢气
| 一定温度下氢气能还原氧化铁得到铁
| Ⅰ对;Ⅱ对;无
| C
| 铁属于过渡元素
| 铁和铁的某些化合物可用作催化剂
| Ⅰ错;Ⅱ对;无
| D
| 在空气中铁表面形成致密氧化膜
| 铁不能与氧气反应
| Ⅰ对;Ⅱ对;有
?
|
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
|