时间:2017-01-15 16:48:43
1、选择题 某校研究性学习小组设计了如下实验步骤来提取碘:
①加H2O2②将海带烧成灰,向灰中加水搅拌③加CC14振荡④过滤⑤用分液漏斗分液。合理的操作顺序为???????
A.②→④→①→③→⑤
B.②→①→③→④→⑤
C.③→①→②→⑤→④
D.①→③→⑤→②→④
参考答案:A
本题解析:要提取碘,则应该用氧化剂把碘离子氧化生成单质碘,然后利用碘单质易溶在有机溶剂中,通过萃取即可,答案选A。
本题难度:简单
2、实验题 (11分)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾,工业上常用浓硫酸吸收三氧化硫。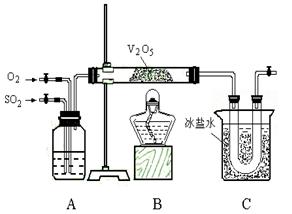
试回答:
(1)已知6.4 g 二氧化硫被氧气氧化成气态三氧化硫,放出9.83 kJ热量。反应的热化学方程式为____________________________________________________;
(2)A装置可用来观察二氧化硫和氧气的进气量。实验时使A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是___________________________;
(3)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是________________________________。
(4)C装置用来收集三氧化硫,若用a g铜跟足量浓硫酸反应制二氧化硫,实验结 束时得到b g 三氧化硫,该实验中二氧化硫的转化率不小于_________________;
束时得到b g 三氧化硫,该实验中二氧化硫的转化率不小于_________________;
(5)为了减轻实验对环境的污染,请你设计尾气处理装置,绘出装置图:
__________________________________________________________ ?????????。
?????????。
参考答案:(11分)
(1)SO2(g)+本题解析:略
本题难度:一般
3、实验题 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。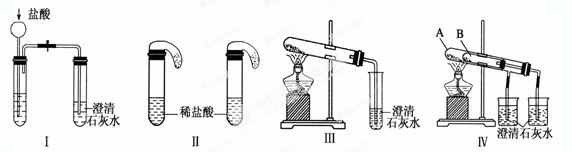
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)___???_______;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其都发生的反应的化学方程式为_____________???????????????????___________;与实验Ⅲ相比,实验Ⅳ的优点是__________________________;
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________;
(4)有同学认为,除上述试验方法外,向两种固体配成的溶液中加入澄清石灰水也可以区分它们,这种说法是_____________(填“正确”或“错误”)的。
(5)将碳酸氢钠溶液与足量的澄清石灰水混合并充分反应,其离子方程式为_________________________。其剩余溶液的溶质化学式为___________
(6)另有两瓶溶液,已知分别是K2CO3和NaHCO3,请你写出两种不同的鉴别方法。
①________________________________________________________________________;
②_______________________________________________________________________。
参考答案:(1)Ⅱ(2)2NaHCO3本题解析:
试题分析:(1)无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,故Ⅰ无法鉴别;实验Ⅱ中,盐酸和碳酸氢钠反应立即产生气泡,盐酸和碳酸钠先反应生成碳酸氢钠,碳酸氢钠和盐酸反应生成二氧化碳气体,所以看到的现象不同,故能鉴别碳酸钠和碳酸氢钠。
(2)碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳,反应的化学方程式是2NaHCO3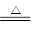 Na2CO3+H2O+CO2↑。CO2能使澄清的石灰水变混浊,则反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O。与实验相比,实验Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行。
Na2CO3+H2O+CO2↑。CO2能使澄清的石灰水变混浊,则反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O。与实验相比,实验Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行。
(3)碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定,所以试管B中装入的固体最好是碳酸氢钠。
(4)澄清石灰水均能和碳酸氢钠以及碳酸钠反应生成白色沉淀碳酸钙,不能鉴别,所以这种说法是错误的。
(5)如果澄清的石灰水过量,则碳酸氢钠和石灰水反应生成物是碳酸钙、氢氧化钠和水,反应的离子方程式是HCO3-+Ca2++OH-=CaCO3↓+H2O。因此剩余溶液的溶质化学式为Ca(OH)2、NaOH。
(6)①根据盐中阳离子的不同,可以通过焰色反应鉴别,即利用焰色反应,隔蓝色钴玻璃观察,能看到紫色焰色的是K2CO3,否则是2NaHCO3。
②根据盐中阴离子的不同,可以利用沉淀法鉴别。即加入BaCl2(CaCl2)溶液,产生白色沉淀的是K2CO3,否则是2NaHCO3。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。明确物质的性质和实验原理,是答题的关键。
本题难度:一般
4、选择题 下列与实验相关的叙述中,正确的是
A.加热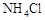 晶体时,将湿润的红色石蕊试纸靠近试管口,检验
晶体时,将湿润的红色石蕊试纸靠近试管口,检验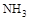 的生成
的生成
B.向某溶液中加入足量盐酸酸化,无现象,再加人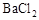 溶液,有白色沉淀生成,说明原溶液中存在
溶液,有白色沉淀生成,说明原溶液中存在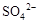
C.酸碱中和滴定实验中用到的玻璃仪器仅有酸式滴定管、碱式滴定管和烧杯
D.用量筒量取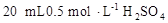 溶液于烧杯中,加水80mL,,配制成0.1
溶液于烧杯中,加水80mL,,配制成0.1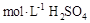 溶液
溶液
参考答案:B
本题解析:
试题分析:A、加热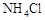 晶体时,晶体在试管底部分解,产生氨气和氯化氢气体。当二者到试管口时,由于此处的温度较低,因此二者会重新结合,生成氯化铵晶体。故错误。
晶体时,晶体在试管底部分解,产生氨气和氯化氢气体。当二者到试管口时,由于此处的温度较低,因此二者会重新结合,生成氯化铵晶体。故错误。
B、正确。
C、酸碱中和滴定实验中用到的玻璃仪器有酸式滴定管、碱式滴定管、烧杯、锥形瓶、玻璃棒。故错误。
D、由于分子间存在间隙,因此两个体积相加后,其总体积不会刚好等于100mL,因此无法配成0.1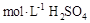 溶液。而且配制硫酸溶液时,一般为硫酸缓缓倒入水里,而不是水倒入硫酸中,故D项错误。综上,答案选B。
溶液。而且配制硫酸溶液时,一般为硫酸缓缓倒入水里,而不是水倒入硫酸中,故D项错误。综上,答案选B。
点评:对化学实验的考查是历年高考的重点,考生在备考过程中应注意对化学实验的相关知识的积累,尤其是课本中涉及到的制备实验,应多加关注。
本题难度:简单
5、选择题 草酸晶体(H2C2O4·2H2O)? 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)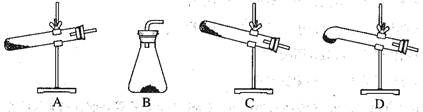
参考答案:D
本题解析:草酸晶体受热时会熔化,同时反应中生成水蒸气,为避免液体回流,装置只能选择D。答案选D。
本题难度:一般