时间:2017-01-15 16:30:57
1、选择题 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是 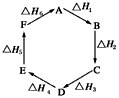 [???? ]
[???? ]
A.A→F,ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C→F,|ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
参考答案:B
本题解析:
本题难度:一般
2、选择题 根据碘与氢气反应的热化学方程式 (i) I2(g)+ H2(g)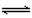 2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g)
2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g)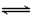 2HI(g) - 26.48 kJ 下列判断正确的是 [???? ]
2HI(g) - 26.48 kJ 下列判断正确的是 [???? ]
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
参考答案:D
本题解析:
本题难度:一般
3、选择题 已知4NH3(g)+5O2(g)?=?4NO(g)?+6H2O(l)?△H=-xkJ/mol。蒸发1mol?H2O(l)需要吸收的能量为44kJ,其它相关数据如下表
则表中z(用x、a、b、d表示)的大小为[???? ]
A.(x+4a+5b-6d-44)/4???????????
B.(x+12a+5b-12d-264)/4?????????
C.(x+4a+5b-6d-264)/4??????????
D.(x+12a+5b-12d-44)/4
参考答案:C
本题解析:
本题难度:一般
4、简答题 工业合成氨与制备硝酸一般可连续生产,流程如下: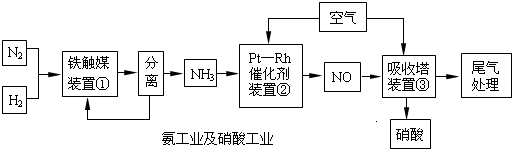
完成下列问题:
Ⅰ.合成氨
(1)写出装置①中发生反应的化学方程式:______.
(2)已知在一定的温度下进入装置①的氮、氢混合气体与从合成塔出来的混合气体压强之比为5:4,则氮的转化率为______.
Ⅱ.氨的接触氧化原理
(3)在900℃装置②中反应有:?
4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-905.5kJ?mol-1?K1=1×1053?(900℃)
4NH3(g)+4O2(g)?4N2O(g)+6H2O(g);△H=-1103kJ?mol-1??K2=1×1061?(900℃)
4NH3(g)+3O2(g)?2N2(g)+6H2O(g);△H=-1267kJ?mol-1??K3=1×1067?(900℃)
除了上列反应外,氨和一氧化氮相互作用:
4NH3(g)+6NO(g)?5N2(g)+6H2O(g);△H=-1804kJ?mol-1,还可能发生氨、一氧化氮的分解.
完成热化学方程式:2NO(g)?N2(g)+O2(g);△H=______.
(4)铂-铑合金催化剂的催化机理为离解和结合两过程,如图所示: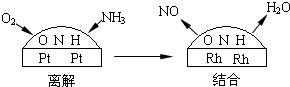
由于铂对NO和水分子的吸附力较小,有利于氮与氧原子结合,使得NO和水分子在铂表面脱附,进入气相中.若没有使用铂-铑合金催化剂,氨氧化结果将主要生成______.说明催化剂对反应有______.
(5)温度对一氧化氮产率的影响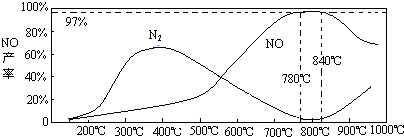
当温度大于900℃时,NO的产率下降的原因______(选填序号)
A.促进了一氧化氮的分解
B.促进了氨的分解
C.使氨和一氧化氮的反应平衡移动,生成更多N2
(6)硝酸工业的尾气常用Na2CO3溶液处理,尾气的NO、NO2可全部被吸收,写出用Na2CO3溶液吸收的反应方程式______.
参考答案:(1)氮气的氢气在催化剂、加热加压的条件下生成氨气的反应为:
本题解析:
本题难度:一般
5、填空题 已知下列热化学方程式:
(1)Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g) ΔH=-25kJ·mol-1
(2)3Fe2O3(s)+CO(g)====2Fe3O4(s)+CO2(g) ΔH=-47kJ·mol-1
(3)Fe3O4(s)+CO(g) ====3FeO(s)+CO2(g) ΔH= +19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式:_________________________________。
参考答案:FeO(s)+CO(g)==Fe(s)+CO2(g) ΔH=
本题解析:
本题难度:一般