时间:2017-01-13 10:26:30
1、选择题 纳米材料的表面粒子占总粒子的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状与氯化钠晶胞的大小和形状相同,则这种纳米颗粒的表面粒子数与总粒子数的比值为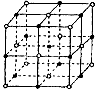 [???? ]
[???? ]
A.7:8
B.13:14
C.25:26
D.26:27
参考答案:D
本题解析:
本题难度:一般
2、填空题 (15分)血红素中含有C、O、N、Fe五种元素。回答下列问题:
⑴C、N、O、H四种元素中电负性最小的是?????????????(填元素符合),写出基态Fe原子的核外电子排布式??????????。
⑵下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有????????????,在右图的方框内用“→”标出Fe2+的配位键。
⑶NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
⑷N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是: ???
???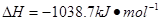
若该反应中有4mol N—H键断裂,则形成的 键有___________mol。
键有___________mol。
⑸根据等电子原理,写出CN—的电子式???????, 1 mol O22+中含有的π键数目为?????。
⑹铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为???,δ、α两种晶胞中铁原子的配位数之比为???。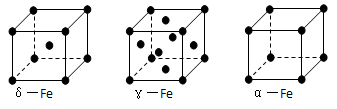
参考答案:⑴H (1分)?? [Ar]3d64S2(2分)
⑵s
本题解析:(1)非金属性越强,电负性越大,故是H。根据构造原理可写出基态Fe原子的核外电子排布式。
(2)根据结构图可看出N原子既有单键还有双键,所以既有sp2杂化,还有sp3杂化。N原子最外层有孤对电子,而亚铁离子有容纳电子的空轨道,所以可形成配位键。
(3)离子晶体中离子键越强,熔沸点越高,形成离子键的微粒半径越小,所带电荷数越多,离子键越强,所以NiO> FeO的。
(4)反应中有4mol N—H键断裂,则生成1.5mol氮气,氮氮三键由2个本题难度:简单
3、填空题 (10分)如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。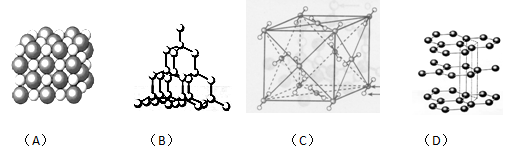
(1)其中代表金刚石的是(填编号字母,下同)??????,金刚石属于??????????晶体。
(2)其中代表石墨的是????????????,其晶体中碳原子呈平面????????结构排列。
(3)其中代表NaCl的是????????,晶体中Na+与Cl-之间通过?????????键结合起来。
(4)代表干冰的是??????,它属于??????晶体,CO2分子间通过?????????结合起来。
(5)上述物质中前三种熔点由高到低的排列顺序为???????????????????????????。
参考答案:(1);B;原子???????(2)D;层状????????
本题解析:考查晶体的有关判断。只含分子的晶体是分子晶体。原子间以共价键相互结合,并向空间扩展,形成三维网状结构的晶体是原子晶体。阳离子和阴离子通过离子键结合而成的晶体是离子晶体。所以NaCl、CsCl、干冰、金刚石分别属于离子晶体、离子晶体、分子晶体和原子晶体。石墨属于混合型晶体,同一层内靠共价键结合,层和层之间靠分子间作用力结合。一般情况下原子晶体的熔点高于离子晶体的,离子晶体高于分子晶体的。
本题难度:一般
4、填空题 已知有关物质的熔、沸点数据如下表:
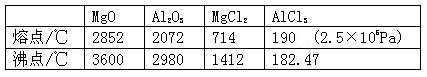
请参考上述数据回答下列问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?
答___________????????????????????????????????????????????????。 (2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是__?????_____。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是__?????_____。
参考答案:每空2分,共4分。
(1)MgO的熔点比MgCl2高,
本题解析:略
本题难度:一般
5、选择题 有资料表明,只有钋的晶体中的原子具有如图所示的堆积方式,钋的外围电子排布式是6s26p4。下列关于该元素的说法不正确的是(??)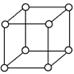
A?上图的堆积方式空间利用率太低,金属极少采取这种堆积方式???????????????
B?钋晶体中原子的配位数为6
C?钋基态原子的能层数=周期序数=价电子数
D?钋的常见化合价为+4、+6、-2价
参考答案:D
本题解析:钋的外围电子排布式是6s26p4,所以钋元素位于第六周期第ⅥA。由于是金属元素,所以不可能有负价,所以选项D是错误的,其余都是周期的,答案选D。
本题难度:简单