时间:2017-01-13 10:24:12
1、选择题 如果两个电子自旋方向相反的氢原子互相靠近时,两个原子轨道则发生重叠,当核间距为74pm时,两个原子轨道发生最大程度的重叠,此时体系的能量最低。下图表示两个气态基态氢原子相互接近形成氢气分子时,体系能量随两个原子的核间距离变化的曲线图,下列关于氢原子形成氢分子说法不正确的有  [???? ]
[???? ]
A.氢分子比氢原子稳定
B.氢原子的半径约为37pm
C.形成一个H-H键吸收436kJ能量
D.当核间距接近74pm时,形成了氢分子中s~s σ键
参考答案:C
本题解析:
本题难度:一般
2、推断题 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大。W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍。请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
(l)W、Y、Z 三种元素的第一电离能由大到小的顺序为????。在上述三种元素的原子中,写出与WZ2互为等电子体的分子式????????????。
(2)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键)
该分子中Y原子的杂化方式是??????????杂化。
(3)W2-2阴离子的电子式为???????,Z原子最外层电子排布式为????????????。
(4)YQ3分子的空间构型为?????????,Y和Q两元素的氢化物的沸点相比较,高者是????(写分子式).往硫酸铜溶液中通入过量的YH3(Y的氢化物分子式),可生成配离子[Cu(YH3)4]2+,但YQ3不易与Cu2+形成配离子,其原因是????????????????????????????。
(5)科学家通过X射线探明RZ的晶体结构与NaCl晶体结构相似。那么在RZ晶体中距离R2+最近且等距离的R2+有????个。若在RZ晶体中阴阳离子间最近距离为a cm,晶体密度为ρg/cm3,则阿伏伽德罗常数NA的表达式为??????mol-1。
(6)已知非整数比化合物R0.95?Z,其晶体结构与NaCI相似,但由于R、Z离子个数比小于1:1,故晶体存在缺陷。R0.95Z可表示为(???)
参考答案:
(1)N>O>C;?? N2O
(
本题解析:
(1)根据题意“W原子核外有2个未成对电子”,1s22s22p2,W应为C,“Q是电负性最大的元素”Q应为F,“R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍”,R的电子排布式应为[Ar]4s23d6,R为Fe,W、Y、Z的电负性关系为N>O>C;CO2的电子数为22,与其是等电子体的是N2O。
据键角为120 。,故Y原子的杂化方式应为SP2。
联想到CaC2,可写出C2-的电子式;Z为氧,最外层电子排布式为2s22p4。
联想NH3的空间构型,则NF
本题难度:困难
3、填空题 下面是C60、金刚石和二氧化碳的分子模型。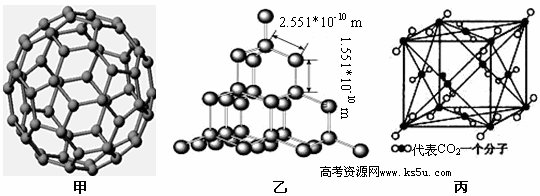
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:_________________
(2)从晶体类型来看,C60属于_________晶体。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是__________________________;晶体硅中硅原子与共价键的个数比为????????????
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有________个二氧化碳分子,二氧化碳分子中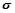 键与
键与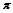 键的个数比为????????????????。
键的个数比为????????????????。
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷分子中2号碳原子的杂化方式是_______,丙烯分子中2号碳原子的杂化方式是_______,丙烯分子中最多有??????个原子共平面。
参考答案:(1)1s22s22p63s23p2?(2)分子 (3)6?
本题解析:
试题分析:(1)硅的原子数序为14,基态时的核外电子排布式为1s22s22p63s23p2;(2)由题给结构模型知,C60有固定的组成,不属于空间网状结构,为分子晶体;(3)由题给结构模型知,金刚石中的最小环为六元环,二氧化硅结构跟金刚石结构相似,Si、O原子形成的最小环上应有6个Si原子,硅晶体结构中每个硅与硅的化学键之间插入一个O原子,则Si、O原子形成的最小环上O原子的数目是6,二氧化硅晶体中,每个Si原子与4个O原子形成共价键,每一个共价键中Si的贡献为一半,则平均1个Si原子形成2个共价
本题难度:一般
4、选择题 下列各组互为等电子体的是
A.N2O和CO2
B.O3和NO2
C.CH4和NH3
D.OH-和NH2-
参考答案:A
本题解析:略
本题难度:简单
5、简答题 C、N、O是中学化学常见的三种元素,请回答下列问题:
(1)写出基态O2-的核外电子排布式______________________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为_____________________________。
(3)光气(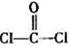 )分子中含有______个
)分子中含有______个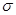 键,____个
键,____个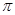 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。
(4)水的熔点比H2S的熔点高,其原因是________________。
(5)超硬材料氮化销的晶胞如图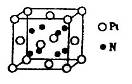 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。
参考答案:(除注明外,每空1分,共8分)(1)1s22s22p6?(2
本题解析:
试题分析:(1)O2-核外有10个电子,根据构造原理可知,其核外电子排布式为1s22s22p6。
(2)同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由大到小的顺序为N<O<C。
(3)单键都是σ 键,双键是由一个σ 键和1个π键构成的。所以根据光气的结构式可知,光气分子中含有3σ键,一个π键,碳原子含有3个σ 键且不含孤电子对,所以其杂化方式为sp
本题难度:一般