时间:2017-01-13 09:39:31
1、简答题 某金属元素R的单质0.9g与硫酸完全反应时可生成R2(SO4)3,并生成1.12L氢气(标准状况).已知该元素的原子核中有14个中子.试通过计算确定该元素的名称及其在周期表中位置.
参考答案:令0.9g金属的物质的量为n,根据电子转移守恒,则:
本题解析:
本题难度:一般
2、填空题 氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+
与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式???????????????????????????????。
⑵NH2-的电子式为???????????????。??????
⑶N3-有????????个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式?????、????。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型???????????????????。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是???????????。
参考答案:⑴N2H62++2OH-=N2H4+2H2O?????⑵ 本题解析: 本题难度:一般 3、选择题 已知C3N4晶体很可能具有比金刚石还大的硬度,且原子间均以单键结合.下列关于C3N4晶体的说法正确的是( ) 参考答案:C 本题解析: 本题难度:简单 4、填空题 (14分)现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。 参考答案:(1)3;纺锤形或哑铃形?(2)泡利不相容?(3)第三周期第 本题解析: 本题难度:一般 5、选择题 下列各组元素相互化合,既能形成离子化合物,又能形成共价化合物的是( ) 参考答案:D 本题解析: 本题难度:简单
试题分析:⑴NH4+与碱反应的离子方程式为:NH4++OH-=NH3+H2O。由于NH4+与N2H62+结构相似,所以N2H62+在碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O。⑵NH2-是NH3失去质子后形成的。所以NH2-的电子式为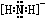 。⑶N是7号元素,所以N3-有22个电子。
。⑶N是7号元素,所以N3-有22个电子。
A.C3N4晶体是分子晶体
B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过离子键结合
A元素原子的核外p电子总数比s电子总数少1 B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 C原子核外所有p轨道全满或半满 D元素的主族序数与周期数的差为4 E是前四周期中电负性最小的元素 F在周期表的第七列
(1)A基态原子中能量最高的电子,其电子云在空间有????????个方向,原子轨道呈???????形。
(2)某同学根据上述信息,所画的B电子排布图如图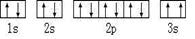 ,违背了??原理。
,违背了??原理。
(3)F位于??????????族??????区,其基态原子有?????种运动状态。
(4)CD3 中心原子的杂化方式为?????,用价层电子对互斥理论推测其分子空间构型为????????,检验E元素的方法是???????????????。
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为???????,该单质晶体中原子的堆积方式为四种基本堆积方式中的??????。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。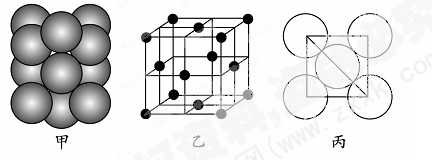
试题分析:A、B、C、D、E为短周期主族元素,原子序数依次增大,A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,即A为N;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C原子核外所有p轨道全满或半满,结合原子序数可知,价电子为3s23p3符合题意,即C为P;D元素的主族序数与周期数的差为4,原子序数大于P,则D为第三周期第ⅦA族元素,即D为Cl;E是前四周期中电负性最小的元素,则E为K;F在周期表的第七列
A.C、H、O???????? B.K、Mg、Cl??????? C.N、Cl、H?????? D.Na、S、H
C、H、O是非金属元素,各元素相互化合只能形成共价键不能形成离子键,所以这三种元素相互化合只能形成共价化合物不能形成离子化合物,故A错误.
K、Mg是活泼金属元素,Cl是活泼非金属元素,K、Mg和Cl只能形成离子键不能形成共价键,所以只能形成离子化合物不能形成共价化合物,故B错误.
B、N、Cl、H是非金属元素,各元素相互化合只能形成共价键不能形成离子键,所以这三种元素相互化合只能形成共价化合物不能形成离子化合物,故C错误.
Na是活泼金属元素,S、H是非金属元素,Na和S、