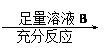?????????????????????????????????????????????
????????????????????????????????????????????。
?
参考答案:(1)B中品红溶液褪色 (1分)
(2)停止加热时,能
本题解析:
试题分析:(1)二氧化硫的特性是使品红溶液褪色,因此能说明有SO2气体产生的实验现象是:B中品红溶液褪色。
(2)停止加热时,装有铁和浓硫酸的试管中压强减小,有这样一根导管能防止倒吸或平衡压强。
(3)2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4(2分)
(4)想让反应开始,把铁丝推一下让其接触浓硫酸,想让反应停止时,将铁丝拉离浓硫酸,这样便于控制反应的发生和停止
(5)铁离子与硫氰化钾反应可以生成血红色的溶液,用此来检验三价铁离子,二价铁离子
本题难度:一般
3、填空题 下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应时加入或生成的水,以及生成沉淀J时的其它产物均已略去)。

填写下列空白:
(1)物质B是?????,F是?????,J是?????。
(2)反应①的离子方程式是??????
参考答案:B:Cl2,F:Fe,J:Fe(OH)3
(2)Cl2
本题解析:解答本题应采用正向思维,从电解饱和食盐水的反应入手:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 2NaOH+H2↑+Cl2↑
从题示框图B物质既能与A反应生成D和E,又能与C反应生成G。从电解食盐水的产物分析,只有Cl2符合这特点,它能与氢氧化钠(A)反应生成NaClO(生成的H2O略去)
Cl2+2NaOH=
本题难度:一般
4、实验题 (16分)钢铁工业是国家工业的基础,是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是??????????????。
(2)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6mol/L盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。

填写下列空白:
①实验进行时试管A中应加入的试剂是????????????;烧瓶B的作用是????????????;烧瓶C的作用是????????????????????。
②实验时,U型管G中加入的试剂是????????????;长颈漏斗H中应加入???????。
③试管E中发生反应的化学方程式是??????????????。
④为了安全,在E管中的反应发生前,在F出口处必须???????????。
参考答案:
 本题解析: 本题解析:
(1)常温下,铁在浓硫酸中发生钝化现象使铁表面形成一层致密稳定的氧化膜,故铁制品容器可以盛放浓硫酸,故答案为:浓硫酸使铁表面形成一层致密稳定的氧化膜;
⑵①根据题干中所提供的物质可以推断出第一步实验中除了生成四氧化三铁外还会生成氢气,发生的反应为铁在高温和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O 本题难度:一般 本题难度:一般
5、填空题 将铁与氧化铁的混合物15g加入150mL稀硫酸中,在标准状况下生成1.68LH2,同时固体物质全部溶解,向溶液中加入KSCN溶液,未见颜色改变。为中和过量的硫酸且使铁全部转化为Fe(OH)2,共消耗3mol/LNaOH溶液200mL,则原硫酸溶液物质的量浓度为?? (??? )
A.2mol/L
B.1.8mol/L
C.4mol/L
D.2.2mol/L
参考答案:A
本题解析:求解对象的始态是H2SO4,终态是Na2SO4,而Na+全部来源于NaOH且所加入的NaOH中的钠最终全部转化为Na2SO4,依电荷守恒原理有3mol·L-1×0.2L×1=0.15L×c(H2SO4)×2,c(H2SO4)=2mol/L。
本题难度:简单
| 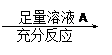 为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案: