时间:2017-01-13 08:35:33
1、实验题 根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么 ?(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量
?(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量 m(H20),由此计算
m(H20),由此计算 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)=" a" g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大 的是_______________ (填序号);
的是_______________ (填序号);
1Cu0未完全起反应?????????② CuO不 干燥
干燥
3Cu0中混有不反应的杂质???④碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或__________ _____和_______________达到实验目的。
_____和_______________达到实验目的。
2、实验题 某研究小组进行与NH3有关的系列实验。
(1)从下图中挑选所需仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。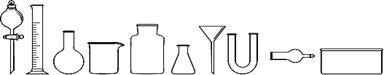
(2)将NH3通入溴水中,有N2生成,反应的化学方程式为????????????????????。
3、实验题 (12分)(1)某化学小组的同学在学习了NaHCO3和Na2CO3的有关知识后,进行如下实验:在两支试管中分别加入3mL4 mol·L-1稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下: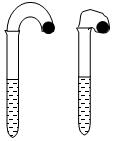
①试管中(填产生沉淀或气体及反应速率等相关现象)___________??????????????_。
②盛______________的试管中气球变得更大,大小气球体积之比约为(填简单整数比)____________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3
的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO3-(aq)+H+(aq)=H2O(l)+CO2(g);?△H>0
CO32-(aq)+2H+(aq)=H2O(l)+CO2(g);?△H<0
甲下结论的方法是否正确____________(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | ?35mL 稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1 mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | ?35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | ?35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ 请你帮助填写相关内容: ①该研究报告的题目是《_____________________________________》; ②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_________和__________;通过上述实验可得出五条结论(用“吸热”或“放热”填写): a:NaHCO3的溶解是_______过程; b:Na2CO3的溶解是_______过程; c:NaHCO3的饱和溶液和盐酸的反应是____________反应; d:Na2CO3的饱和溶液和盐酸的反应是____________反应; e:NaHCO3固体与稀盐酸反应的反应热是______(填a、b、c、d中的字母)的热效应之和。 4、实验题 (12分)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。 5、实验题 Na2CO3是很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程: |