时间:2017-01-13 07:53:21
1、选择题 某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是?
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e一==Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e一==Li
参考答案:B
本题解析:放电时(反应式从左到右的反应),负极上发生氧化反应(化合价升高),正极上发生还原反应(化合价降低),故A错误,B正确。充电时,阳极上发生氧化反应,阴极上发生还原反应,且此时反应是从右到左,故C、D均错误。
本题难度:一般
2、填空题 (10分)电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验: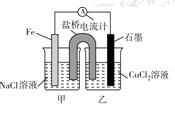
Ⅰ.(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)_______________________________设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________________________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因____________________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨(1)为________极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为_________________________________。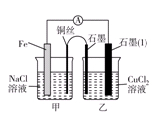
Ⅱ.如右图所示装置,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL。
请完成下列问题: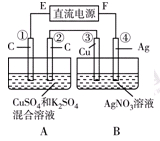
①第②极上生成的物质为________mol。
②写出第①极上发生反应的电极反应式_________________________。
③设A池中原混合液的体积为200 mL,则通电前A池原混合液中Cu2+的浓度为________ mol/L。
参考答案:Ⅰ.(1)Fe+Cu2+=Fe2++Cu ?? 0.2 本题解析: 本题难度:一般 3、选择题 钢铁发生吸氧腐蚀时,正极上发生的反应是 参考答案:C 本题解析:略 本题难度:一般 4、填空题 第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。 参考答案:(1)增大 NiOOH+H2O+e-=Ni(OH)2+OH- 本题解析:(1)从题意可知,混合动力车上坡或加速时,电池应处于放电状态,故负极反应式为:H2+2OH--2e-=2H2O,则正极反应可由总电极反应式减去负极反应式得到,即NiOOH+H2O+e-=Ni(OH)2+OH-,由于在放电时,生成了OH-,故乙电极周围溶液的pH增大。 本题难度:一般 5、选择题 化学在生产和日常生活中有广泛的应用.下列说法不正确的是( ) 参考答案:A.明矾水解生成氢氧化铝胶体,可除去水中的悬浮物,但不能使海 本题解析: 本题难度:简单
试题分析:Ⅰ.由图可知该装置为原电池,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则Fe+Cu2+═Fe2++Cu??两极质量差△m???转移电子
56g???????? 64g??? 56g+64g=120g?????? 2mol
12g???????????????? n
n=0.2mol
(2)若将CuCl2溶液换为NH4Cl溶液,溶液呈酸性,
A.2Fe-4e— =2Fe2+
B.2Fe2++4e— =2Fe
C.2H2O+O2+4e—=4OH—
D.Fe3++e—=Fe2+
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH 2Ni(OH)2
2Ni(OH)2
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH???????(填“增大”、“减小”或“不变”),该电极的电极反应式为???????????????。
(2)Cu2O是一种半导体材料,可通过如图的电解装置制取,电解总反应为:2Cu+H2O Cu2O+H2↑
Cu2O+H2↑
阴极的电极反应式是??????????????????????????????????????????????????????。
用镍氢电池作为电源进行电解,当蓄电池中有1 mol H2被消耗时,Cu2O的理论产量为???????g。
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的???????腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的???????(填“正”或“负”)极相连。
(2)结合装置图及总电池反应式可以得知,H+在阴极放电,故阴极反应式为2H++2e-=H2↑;由总电池反应式可求得,1 mol H2被消耗时,同时生成1 mol Cu2O,其质量为144 g。
A.向海水中加净水剂明矾可以使海水淡化
B.减少使用氟氯代烃的目的是为了保护臭氧层
C.大量使用含磷洗涤剂会造成水体的富营养化
D.镀层破损后,镀锡铁板比镀锌铁板更易腐蚀