2.28
回答如下问题:
(1) ?CuFeS2和O2主要反应的方程式为:
(2) ?实际生产过程的沸腾炉温度为 600~620℃。控制反应温度的方法是:
(3) ?温度高于600~620℃生成物中水溶性Cu (%)下降的原因是:
参考答案:(1)2CuFeS2 + O2 =Cu2S + 2FeS +
本题解析:本题由三个相互独立的问题组成,可以认为是三个题,占总分的较大比例,但由于都是有关黄铜矿的利用问题,因而被编在一起,而且多少相互之间可以起到“条件不同反应不同”的关联作用。与前两题相比,本题的第一部分比较简单,好像是命题人考虑着对前面的试题可能解答得不好的学生起一点安抚鼓励作用。写四个分步反应的方程式的考核点只是把题面的表述转换成化学方程式,但题面并没有指出生成物中的硫的形态。根据中学化学知识,可以想见它是SO2,大多数学生应该不会写错。其中第四个反应就是所谓“冰铜”反应,比较特殊,但试题已经告诉大家反应产
本题难度:一般
3、选择题 下列反应的离子方程式正确的是(???)
A.硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-====Fe(OH)3↓
B.硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-====Fe2S3
C.过量的铁与很稀的硝酸溶液反应无气体放出:4Fe+10H++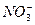 ====4Fe2++3H2O+ ====4Fe2++3H2O+
D.硫化氢气体通入氯化亚铁溶液:H2S+Fe2+====FeS↓+2H+
参考答案:C
本题解析:A选项中缺少 与Ba2+起反应的离子方程式。 与Ba2+起反应的离子方程式。
B选项中Fe3+与S2-发生氧化还原反应,离子方程式为2Fe3++S2-====2Fe2++S↓。
C选项中无气体放出,说明 本题难度:简单 本题难度:简单
4、选择题 纳米是长度单位,l nm="10" -9m,当物质的颗粒达到纳米级时,会具有一些特殊的性质。例如由铜制成“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列关于“纳米铜"的叙述正确的是
A.“纳米铜”比铜片的金属性强
B.“纳 米铜”比铜片更易失去电子 米铜”比铜片更易失去电子
C.“纳米铜"比铜片的氧化性强
D.“纳米铜”的还原性与铜片相同
参考答案:D
本题解析:略
本题难度:一般
5、选择题 向一定量的Cu、Fe2O3的混合物中加入300 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为?? ( )。
A.6.4 g
B.4.8 g
C.2.4 g
D.1.6 g
参考答案:C
本题解析:向混合物中加入盐酸时发生如下反应:Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Cu=CuCl2+2FeCl2,由题意可知:Cu与Fe2O3的物质的量相等,设二者的物质的量均为x,则有6x=0.3 L×1 mol·L-1=0.3 mol,x=0.05 mol;若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量即为氧原子的质量:0.05 mol×3×16 g·mol-1=2.4 g。
本题难度:一般
|