时间:2017-01-12 18:51:51
1、推断题 A-G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色,C是红色的金属单质。它们之间有如下转化关系(其中反应③④⑦的产物中的水已略去)。 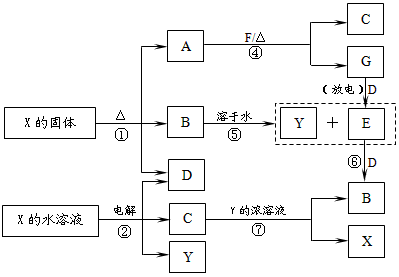
试填空
(1)写出G分子的电子式____________。
(2)写出反应⑦的离子方程式_____________________。
(3)写出电解X溶液的阳极反应式______________________。
(4)写出反应④的化学方程式______________________。
(5)若使F按下列途径完全转化为Y。 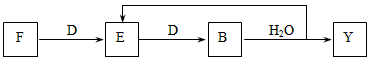
则参加反应的F与整个过程中消耗D的物质的量之比为:___________。
参考答案:(1)本题解析:
本题难度:一般
2、推断题 已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去) 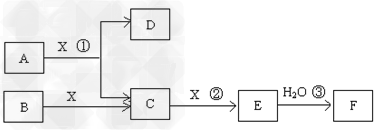
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式:??????????????????????????。
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是???????????????????????????? 。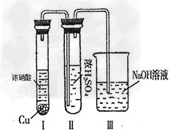
③已知常温下1 mol气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方式______________ 。
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1________V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是_________ 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ___________;
②将少量气体E通入氢氧化钡溶液中得不溶物F,F的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP_____________,(填:增大、减小或不变),此时,组成不溶物F的阴离子在溶液中的浓度为 _____mol/L。
参考答案:(1)①氨气的催化氧化反应方程式“略”
???????
本题解析:
本题难度:一般
3、推断题 下列转化关系图中,A、B、C、D、E常温下为气体,B、E、 F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。?????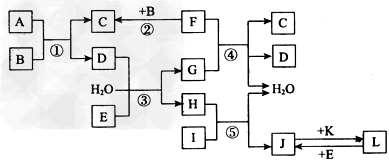
请回答下列问题: ??
(1)E的电子式为_________。 ??
(2)反应③的离子方程式为________。 ??
(3)F与G的浓溶液反应的化学方程式为_________。 ??
(4)检验溶液L中金属阳离子的方法是___________ ??
(5)气体A的密度为相同状况下氢气密度的30倍,且A中含3种组成元素,通过计算、推理,可确定A的分子式为_____________(此分子式中元素符号书写次序按从左往右元素原子序数“大 ??小中”顺序排列);A分子中各原子均达8电子稳定结构,则其结构式为____________。
参考答案:(1)本题解析:
本题难度:一般
4、填空题 已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。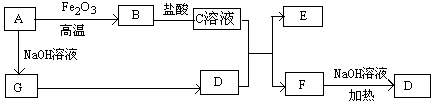
请回答下列问题:
(1)写出F的电子式:?????????????
(2)①C溶液与D反应的离子方程式为????????????????????????????????????????
②F溶液与NaOH溶液共热反应的化学方程式为???????????????????????????????
(3)①请用离子方程式解释C溶液为何显酸性??????????????????????????
②F溶液中离子浓度由大到小的顺序为????????????????????????????????
(4)将5.4gA投入200mL 2.0mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是????????(填代号)
A.HNO3溶液????? B.H2SO4溶液??? C.NaOH溶液? D.HCl溶液
(5)将1molN2和3molG及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2mol/(L·min),则v(D)=???????mol/(L·min)
②在其他条件不变的情况下,若起始时充入0.5molN2和1.5molG达到平衡后,D的物质的量浓度??????(填“大于”、“小于”或“等于”)a/2 mol/L。
③该条件下的平衡常数为????????????(用含a的代数式表示)
参考答案:(1)本题解析:
试题分析:根据题目给定的信息机相应的转化关系可知:A:Al;B:Al2O3;C:AlCl3;D:NH3;E:Al(OH)3;F:NH4Cl;G:H2.(1)氯化铵的电子式略。(2)①C溶液与D反应的离子方程式为:Al3++ 3NH3·H2O=Al(OH)3↓+3NH4+。②F溶液与NaOH溶液共热反应的化学方程式为NH4Cl+NaOH 本题难度:困难
本题难度:困难
5、实验题 (12) 某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。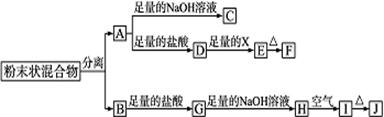
(1)写出下列物质的化学式:F____________________,G_______________
(2)分离粉末状混合物最简单的方法是__________________________________
(3)D→E转化中,加入足量的X,试剂X可能是________
A.饱和NaCl溶液? B.NaOH溶液? C.氨水? D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:_____________________________________________________________________
H→I:____________________________________________________________________
(5)过量的B加入稀硝酸中的化学反应方程式为:____________________________________
(6)若对G溶液中的阳离子进行检验:用所给试剂(KSCN溶液、氯水 )设计检验G溶液中阳离子的方法。?????????????????????????????????????????????????????????????
)设计检验G溶液中阳离子的方法。?????????????????????????????????????????????????????????????
?? ?????????????????????????????????????????????????????????????????????????。
?????????????????????????????????????????????????????????????????????????。
参考答案:(1)Al2O3, FeCl22分(2)用磁铁石吸1分(3)
本题解析:略
本题难度:一般