时间:2017-01-12 18:51:51
1、填空题 如图所示,各项变化的未知物焰色的反应均为黄色,E为淡黄色粉末,据此回答下列问题:
(1)写A→E的化学方程式,标出电子转移的方向和数目。
(2)写出C→D的离子方程式。
(3)在B→C的变化中,所得C的溶液往往不纯,其中的杂质(不包括水)可能是???????,主要原因是????,还可能是????,主要原因是?????。
参考答案:(1) 本题难度:一般 2、填空题 下列①-⑩分别代表有关反应中的一种物质,它们均是中学化学中常见物质.已知①-⑤和⑥-⑩分别含有同一种元素: 参考答案:①能和酸、碱反应,能和酸和碱反应的物质有铝、氧化铝、氢氧化铝 本题解析: 本题难度:简单 3、推断题 有X、Y、Z三种单质和甲、乙、丙三种常见的化合物,它们有如下图及叙述所示的关系,据此回答下列问题 参考答案:⑴① 本题难度:一般 4、填空题 置换反应可用下图表示,回答下列问题: 参考答案:(1)Cl2+2I-= I2+2Cl- 本题解析: 5、填空题 下列关系图中,A是一种正盐,D的分子式比C的大16,E是酸,当X无论是强酸或强碱都有如下反应关系: 参考答案:⑴、(NH4) 2S ,O2??,H2O?????? 本题解析: 本题难度:一般本题解析:考查钠及其化合物的转化
由各物质的焰色的反应均为黄色可判定各物质为钠或钠的化合物,E为淡黄色粉末,可确定为Na2O2;
A点燃可得到Na2O2,可知A为钠单质;
Na2O2与水反应得到B:2Na2O2+2H2O=4NaOH+O2↑,与HCl反应得到D:2Na2O2+4HCl=4NaCl+2H2O+O2↑
B(NaOH)与CO2反应生成碳酸钠,即C:2NaOH+CO2=NaCO3+H2O;C与CO2和水生成碳酸氢钠,即F:Na2CO3+CO2+H2O=2NaHCO3
(1)

(1)分别写出①、⑤、⑧的化学式或离子符号:
①______;⑤______;⑧______.
(2)写出下列反应方程式,是离子反应的写出离子方程式:
①+OH-→______
①+⑥高温
______.
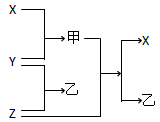
⑴X、Y、Z都是短周期元素的单质,X元素原子的最外层电子数是其次外层电子数的2倍;Y元素有两种常见单质,二者质量相等时其物质的量之比为3 :2;Z元素原子的次外层电子数是其最外层电子数的4倍。则:①写出化合物甲的电子式__________;②写出Z与甲反应的化学方程式____________________。
⑵X、Y、Z都是非金属单质,X是原子晶体,Y、Z都是分子晶体,X、Y都能与强碱溶液反应;乙的水溶液是工业三酸之一,也是实验室常用试剂。则:
①写出X与NaOH溶液反应的离子方程式__________________________________;
②Z与甲的反应的一种重要工业用途是_____________________________________;
③在①所得溶液中加入乙的溶液,观察到的现象__________________________。
⑶X、Z是常见金属,Z与甲的反应只有在高温下才能进行,甲是一种具有磁性的化合物,乙在工业上常用于制取Z单质。则:
①写出乙与NaOH溶液反应的化学方程式___________________________;
②将①所得溶液与小苏打溶液的混合观察到的现象____________________________;
③将等物质的量的X和Z分别与足量的稀硫酸反应,当两种金属完全溶解后,得到气体的质量之比是
____________。
本题解析:
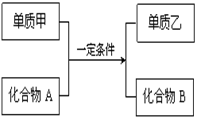
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为
???????????????????????????????????????????????????????????????????????????????。
(2)若过量单质甲与化合物A发生反应的化学方程式为:2Al+Fe2O3 Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是??????????????????????,写出铝粉与所用试剂反应的离子方程式????????????????????????????????????????????????????????。
Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是??????????????????????,写出铝粉与所用试剂反应的离子方程式????????????????????????????????????????????????????????。
(3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
????????????????????????????????????????????????????????????????????????。
(4)若单质乙是黑色非金属固体单质,化合物B是优质的耐高温材料,则该反应的化学方程式为???????????????????????????????????????????????????????????????????????????????。
(2)氢氧化钠
试题分析:(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则为Cl2置换生成I2的反应,离子方程式为:Cl2+2I-= I2+2Cl-。
(2)Al和Al(OH)3都能与NaOH溶液反应,所以可用NaOH溶液除去Fe中的Al和Al(OH)3;Al与OH?、H2O反应生成[Al(OH)4]?和H2,离子方程式为:2Al+2OH-+6H2O=2Al(OH)4-+3H2↑。
(3)Si为常见的半导体材料,C与SiO2发生置换反应可制取Si,化学方程式为:2C+SiO2本题难度:一般

当X是强酸时, A、B、C、D、E均含同一元素;
当X是强碱时, A、B、C、D、E均含另一元素。
回答下列问题(用化学式)
⑴、A是?____ ,Y是?____ ,Z是 ____。
⑵、当X是强酸时,E是?____ ;当X是强碱时,E是?____ 。