时间:2017-01-12 18:51:51
1、推断题 A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。回答下列问题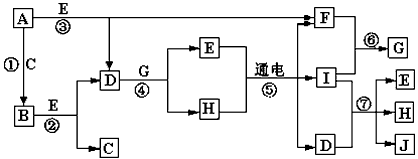
(1)B中的化学键有________(填“离子键”、“极性键”或“非极性键”) E的电子式________。
(2)写出反应⑦的离子方程式 __________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________。
(4)常温下1克F单质在足量C单质中燃烧生成稳定的液态物质E释放出142.9kJ热量,写出液态E分解的热化学方程式________________。
(5)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在________(填“阴或阳”)极附近溶液由无色变为红色,其原因是________________。
2、简答题 A、B、C、D、E为原子序数依次增大的五种短周期元素.E元素最高正价与最低负价的代数和为6,C单质既可与盐酸反应又可与NaOH溶液反应,C、E属同一周期,且能形成1:3型化合物;B原子的最外层电子数比次外层电子数多3;A、D原子序数相差8;若用A、B、D三种元素最高价氧化物分别与足量NaOH溶液反应,在得到的溶液中加入过量稀盐酸,只有一种溶液中能析出白色沉淀Y.
(1)写出E元素和钾元素形成的化合物的化学式______.
(2)C的氧化物与氢氧化钠溶液反应的离子方程式为______.
(3)将红热的A单质投入到B的最高价氧化物对应水化物浓溶液中发生反应的化学方程式为______.
(4)生成白色沉淀Y的离子方程式为______.
(5)在1molD的最高价氧化物形成的晶体中,含有共价键______mol.
3、简答题 以下为中学常见物质,转化关系如下.C与B溶液反应产生气体F,D可在F中燃烧,图中部分产物略去.
(1)写出固体C化学式______.
(2)实验室用①制取D、B溶液应为______溶液(“浓”或“稀”);若用②制取F,B溶液应为______溶液(“浓”或“稀”).写出②反应方程式______.
(3)如何检验E中的阳离子______.
(4)实验室配制G溶液,操作为______.
(5)除③可实现E→G外,请用其他物质实现E→G,化学方程式______.
(6)4gD在空气中完全燃烧生成液体物质时,放出热量为QkJ,写出该反应的热化学方程式______.
4、填空题 下面是有关物质的转化关系图(有些物质己省略),其中A为单质,E在常温下为液体,D是一种含氧的化合物,请回答相关问题。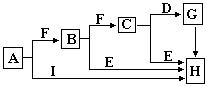
(1)若C的式量为78,则对C的结构、性质推断中不正确的是_____
A.久置于空气中会变成白色??????
B.具有强的氧化性
C.晶体存在离子键与非极性键????
D.与湿润的紫色石蕊试纸接触时,只能使试纸变蓝色
(2)A的原子结构简图______________,H的电子式___________,E的结构式_________
(3)若C也是含氧化合物且氧为18O时,写出C与D反应的方程式___________________
_______________,另一产物(D以外)的摩尔质量为______。
(4)当A量较少时,I不可能是____________
A.H2O??? B.NaCl(aq)????? C.NaOH(aq)??? D.CuCl2
(5)若没有E在常温下为无色液体的限制,则E、I还可分别是_________、_________(填物质名称)
5、实验题 (12分)
用下列几个实验,可快速制取实验室所需的少量气体,并进行相关性质实验。(实验装置如图所示)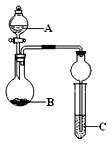
(1)若B中是生石灰,C中盛有AlCl3溶液,将A中液体逐滴加入B内,实验中观察到C溶液中出现白色沉淀。则A中液体的是 (填名称),C中发生反应的离子方程式为 ????????????? 。
(2)若要制O2,B为黑色固体,A中的试剂是????????(填化学式),C中盛有FeCl2和KSCN的混合液,旋开分液漏斗的开关后,发现C中溶液变为血红色,写出C 中发生氧化还原反应的离子方程式 。
(3)已知氧化性强弱:KMnO4>Cl2>KIO3>I2。若A中装有浓盐酸,B中装有固体KMnO4,C中盛有KI淀粉溶液,C中的现象是 ? ,继续反应一段时间后,发现C中溶液的颜色褪去,这是因为 ? 。