时间:2017-01-12 17:56:44
1、选择题 下列说法正确的是
A.将Ca(OH)2饱和溶液加热,溶液的pH增大
B.常温下,pH=11的氨水与pH=3的盐酸等体积混合后,溶液的pH>7
C.将0.1mol/L的HI溶液加水稀释l00倍,溶液中所有离子的浓度随之减小
D.两种醋酸溶液的pH分别为a和(a+1),物质的量浓度分别为c1和c2,则有c1=10c2
参考答案:B
本题解析:A错,Ca(OH)2的溶解度随温度的升高而减小,所以,加热有氢氧化钙析出,溶液的PH减小;B正确,在等体积,氢离子浓度与氢氧根离子浓度相同的情况下,遵循“谁弱谁过量”的原则,即氨水过量,溶液呈碱性,溶液的pH>7;C错,HI溶液加水稀释l00倍溶液中氢离子浓度减小,但氢氧根离子浓度增大;D错,醋酸为弱酸不是强酸。
本题难度:简单
2、选择题 下列叙述正确的是(???)
A.将等体积的PH=3的醋酸溶液和PH=4的醋酸溶液完全中和时消耗氢氧化钠的物质的量,前者是后者的10倍
B.向0.1mol/L的氨水里,加入0.1mol/L的HCl溶液至反应PH=7时,消耗HCl溶液的体积小于氨水的体积
C.pH=3.6的0.1mol/L HX与0.1mol/L NaX的混合溶液中,2c(Na+)=c(X-)
D.0.1mol·L-1的硫化钠溶液中:c(OH-)= c(H+)+ c(HS-)+ c(H2S)
参考答案:B
本题解析:弱电解质的浓度越大,其电离程度越小,所以PH=3的醋酸溶液的物质的量浓度大于PH=4的醋酸溶液的物质的量浓度的10倍,所以A选项错误(或者说:前者c(H+)是后者的10倍,但醋酸的电离程度不同,所以前者的物质的量浓度不是后者的10倍);B选项中,若恰好完全中和生成NH4Cl溶液,显酸性,要使PH=7,氨水应略过量,所以B选项正确;C选项考查的是物料守恒,应是2c(Na+)=c(X-)+ c(HX),所以C错误;D选项考查的是质子守恒,正确的应是:c(OH-)= c(H+)+c(HS-)+2c(H2S)所以
本题难度:一般
3、选择题 一定温度下,用水稀释cmol/L的稀氨水,若用KW表示水的离子积,α表示水的电离度,下列数值随水量的增加而增大的是…( ???)
A.cα
B.KW/c(OH-)
C.c(NH3·H2O)/c([NH4+]
D.KW/α
参考答案:B
本题解析:对一元弱碱有c(OH-)="cα"
加水稀释时,c(OH-)减小,A选项错误。电离平衡右移,α增大。
B项中,KW/c(OH-)=c(H+)增大。
C项中,c(NH3·H2O)/c(NH4+)=(c-cα)/cα=(1-α)/α,α增大,该比值减小。
D项中,KW/α,KW不变,α增大,该比值减小。
本题难度:一般
4、选择题 25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是
A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14
B.b d线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25℃,pH<7
D.CH3COONa溶液不可能位于c点
参考答案:D
本题解析:
试题分析:A、ac曲线为25℃时的离子积常数曲线,在其任意一点上c(H+)·c(OH-)=10-14,故A正确;B、bd线段c(H+)=c(OH-),其任意一点对应的溶液都呈中性,故B正确;C、bd线对应溶液中c(H+)与c(OH-)相等,温度升高曲线向d点移动c(H+)与c(OH-)相等的值变小,故C正确;D、CH3COONa溶液中CH3COO-离子水解产生OH-离子,使溶液中c(OH-)> c(H+),故D错误。
本题难度:一般
5、选择题 用水稀释0.lmol·L-1的氨水时,溶液中随着水量的增加而减小的是
A.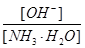
B.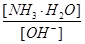
C.[H+]和和[OH-]的乘积
D.OH-的物质的量
参考答案:B
本题解析:氨水中存在如下平衡: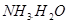 ?
?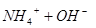 加水稀释,平衡将向右移动,所以A错,根据电离常数只受温度影响,只要温度不变电离常数不变,所以
加水稀释,平衡将向右移动,所以A错,根据电离常数只受温度影响,只要温度不变电离常数不变,所以
本题难度:一般