时间:2017-01-12 17:54:46
1、选择题 若ABn的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥理论,下列说法正确的是??????????????????????????????????????????????????????????????????????????????????????????????(???)
A.若n = 2,则分子的立体结构为V形
B.若n = 3,则分子结构为三角锥形
C.若n = 4,则分子的立体结构为正四面体形
D.以上说法都不正确
2、选择题 下列关于分散系的说法正确的是
A.胶体有比较大的比表面积,能吸附离子使胶体带电荷
B.饱和溶液的导电能力一定比不饱和溶液强
C.浓溶液的导电能力一定比稀溶液强
D.胶体具有丁达尔效应
3、计算题 一种称为“摇头丸”的毒品已从国外流入我国,严重损害一些吸毒者的身心健康,司法机关予以坚决查缉和打击。已知该毒品中氮的质量分数为10.37%,试完成下列问题:
(1)“摇头丸”的分子结构可能是(???)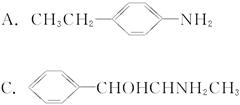 ??????
??????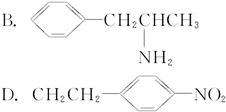
(2)据①中“摇头丸”的分子结构分析,处于同一平面上的碳原子至少有(???)
A.6个??????????? B.7个??????????? C.8个??????????? D.9个
(3)固体“摇头丸”属于(???)
A.分子晶体???????????????????????? B.原子晶体
C.离子晶体???????????????????????? D.金属晶体
(4)摇头丸在一定条件下能否与浓HNO3发生硝化反应?(填“能”或“不能”)______________。
(5)写出 “摇头丸”在加热加压和有催化剂时跟H2反应的方程式:_____________________。
(6)“摇头丸”能否跟浓盐酸反应?若能,写出生成物的结构简式;若不能,请说明理由__________________________________________________________。
4、填空题 氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答: ??
(1)Na3N的电子式是____,该化合物是由____键形成的。 ??
(2)Na3N与盐酸反应生成________种盐,其电子式是____________________。 ??
(3)Na3N与水的反应属于________反应。 ??
(4)比较Na3N中两种离子的半径大小:r(Na+) ______(填“>”“<”或“=”)r(N3-)。
5、选择题 已知:元素X的电负性数值为2.5,元素Y的电负性数值是3.5,元素Z的电负性数值为1.2,元素W的电负性数值为2.4。你认为上述四种元素中,哪两种最容易形成离子化合物
[???? ]