时间:2025-06-26 04:04:57
1、选择题 在36 g 碳不完全燃烧所得气体中,CO占体积1/3,CO2占体积2/3,且
C(s) + 1/2O2(g) = CO(g) △H = -110.5 kJ/mol
CO(g) + 1/2O2(g) = CO2(g) △H = -283 kJ/mol
与这些碳完全燃烧相比,损失的热量是
[? ]
A.172.5 kJ
B.1149 kJ
C.283kJ
D.517.5 kJ
2、填空题 已知:Na2CO3?10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ?mol-1
Na2CO3?10H2O(s)═Na2CO3?H2O(s)+9H2O(g)△H1=+473.63kJ?mol-1
写出Na2CO3?H2O脱水反应的热化学方程式______.
3、简答题 本题包括两个小题
A.①CaCO3(s)═CaO(s)+CO2(g);△H=-177.7kJ/mol
②0.5H2SO4(l)+NaOH(l)═0.5Na2SO4(l)+H2O(l);△H=-57.3kJ/mol
③C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol
④CO(g)+1/2O2(g)═CO2(g);△H=-283kJ/mol
⑤HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l);△H=-57.3kJ/mol
(1)上述热化学方程式中,不正确的有______.(填序号,以下同)
(2)上述反应中,表示燃烧热的热化学方程式是______;
上述反应中,表示中和热的热化学方程式是______.
B.已知热化学方程式:
C(S,金刚石)+O2(g)=CO2(g)△H=-395.41KJ/mol,
C(S,石墨)+O2(g)=CO2(g)△H=-393.51KJ/mol
则金刚石转化为石墨的热化学方程式为______,由热化学方程式看来更稳定的碳的同素异形体是______.
4、选择题 已知:(1)
(2)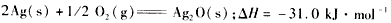
则Zn(s) +Ag2O(s)=ZnO(s) +2Ag(s)的△H等于
[? ]
A.-317.3 kJ/mol
B.-379.3 kJ/mol
C.-332. 8 kJ/mol
D.317.3 kJ/mol
5、选择题 已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和
-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
[? ]