时间:2025-06-26 04:01:41
1、简答题 铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸.电池总反应式为:Pb+PbO2+4H++2SO42-

参考答案:(1)电池总反应式为:Pb+PbO2+4H++2SO42-放电
本题解析:
本题难度:一般
2、填空题 依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。 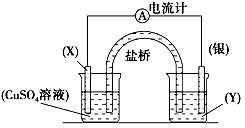
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是____________;
(2)银电极为电池的______________极,发生的电极反应为________________;X电极上发生的电极反应为_______________;
(3)外电路中的电子是从________电极流向________电极。
参考答案:(1)铜;AgNO3溶液
(2)正;Ag++e-→Ag;Cu→Cu2++2e-
(3)铜;银
本题解析:
本题难度:一般
3、选择题 下列各个装置中铁棒被腐蚀由易到难的顺序是正确的是( )
① ② ③ ④
A.③①②④
B.④①③②
C.①③②④
D.②④①③
参考答案:C
本题解析:金属在不同环境中的腐蚀顺序:原电池(作负极)> 原电池(作正极)> 潮湿空气>电解池(作阴极)
考点:原电池,电解池,金属腐蚀速率
点评:金属腐蚀常常利用到原电池的原理,而原电池反应比一般的化学反应要快,而我们也可以利用原电池来保护金属不受腐蚀。
本题难度:简单
4、选择题 普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O═Cu2O+2Ag,下列有关说法正确的是( )
A.装置中电流方向由Cu经导线到Ag2O
B.测量原理示意图中,Ag2O为负极
C.负极的电极反应式为:2Cu+2OH--2e-═Cu2O+H2O
D.电池工作时,OH-向正极移动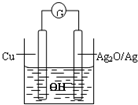
参考答案:A、该原电池中,铜作负极,氧化银作正极,电流从正极氧化银流向负极铜,故A错误.
B、在总反应中Ag2O作氧化剂,氧化剂在原电池中作正极,故B错误;
C、原电池的负极铜失电子和氢氧根离子反应生成氧化铜和水,故C正确;
D、电池工作时电子由负极通过外电路流向正极,由电荷守恒可知,带负电荷的阴离子应该流向负极,故D错误
本题解析:
本题难度:一般
5、填空题 (1)选择适宜的材料和试剂设计一个原电池,完成下列反应:Zn + CuSO4 = ZnSO4 + Cu
①画出装置图:____________________
②电极材料和电解质溶液各是什么?_____________________
③写出电极反应式:正极:______________________;负极:______________________。
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气___________L(标准状况下)。导线中通过____________mol电子。
参考答案:(1)①
②负极:锌片,正极:铜片,CuSO4溶液;③负极:Zn-2e-==Zn2+,正极:Cu2++2e-==Cu
(2)1.12L;0.1mol
本题解析:
本题难度:一般