时间:2025-06-26 04:01:41
1、填空题 如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式〔当电解质溶液为NaOH(aq)或KOH(aq)时〕两种。试回答下列问题: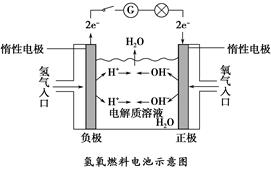
(1)酸式电池的电极反应:负极_______________,正极______________;电池总反应:________________;
电解质溶液pH的变化________(填“变大”“变小”或“不变”)。
(2)碱式电池的电极反应:负极_________________,正极_________________;电池总反应:______________;电解质溶液pH的变化________(填“变大”“变小”或“不变”)。
参考答案:(1)2H2-4e-=4H+ O2+4e-+4H+=2H2O 2H2+O2=2H2O 变大
(2)2H2-4e-+4OH-=4H2O O2+4e-+2H2O=4OH- 2H2+O2=2H2O 变小
本题解析:(1)正极上,O2得电子变为O2-,溶液中O2-不能单独存在;酸性条件下与H+结合生成H2O。负极上,H2失电子变为H+,H+进入电解质溶液。电池总反应为H2和O2生成水的反应,由于有水生成,溶液将逐渐变稀,故pH增大。
(2)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,碱性条件下与H2O分子结合生成OH-;负极上,H2失去电子变为H+,碱性条件下H+不能大量存在,与OH-结合生成水。电池总反应也是H2和O2生成水的反应。同样,由于有水生成,c(OH-)变小,pH变小。
本题难度:一般
2、选择题 X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X表面有Z析出,X与Y组成原电池时,Y为负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Y>Z>X
参考答案:C
本题解析:X浸入Z的硝酸盐溶液中,X表面有Z析出,所以X的金属性强于Z的;X与Y组成原电池时,Y为负极,因此Y的金属性强于X的,所以金属性强弱顺序是Y>X>Z,答案选C。
考点:考查金属性强弱判断
点评:比较元素金属性强弱的一般依据是:1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强;2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强;3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强;4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属;5.依据金属活动性顺序表(极少数例外);6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强;7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
本题难度:一般
3、选择题 某原电池结构如图所示,下列有关该原电池的说法正确的是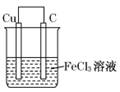
A.能将电能转换成化学能
B.碳棒发生氧化反应
C.该装置中发生的反应为:Cu+2 Fe3+=2 Fe2++Cu 2+
D.电子从碳棒经外电路流向铜棒
参考答案:C
本题解析:
正确答案:C
A.不正确,能将化学能转换成电能
B.不正确,碳棒发生还原反应:Fe3++e-=Fe2+
C.正确;
D.不正确,电子从铜棒经外电路流向碳棒
本题难度:简单
4、实验题 某化学研究小组将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置。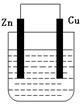
(1)若电解质溶液是稀硫酸,则发生氧化反应的是 极(填“锌”或“铜”,下同),溶液中的H+ 移向 极,铜极上的电极反应式是 。
(2)若电解质溶液是硫酸铜溶液,铜极上的电极反应式是? ?,若反应过程中有0.2mol电子发生转移,则电解质溶液质量增加 g。
参考答案:(1)锌(1分);?铜(1分) ;? 2H++2e-= H2↑(1分);
(2)Cu2+ +2e- = Cu(1分); 0.1 (1分)
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极。
(1)如果是稀硫酸,则发生氧化反应的是锌,氢离子向正极移动,即向铜电极移动,方程式为2H++2e-= H2↑。
(2)如果是硫酸铜,则正极是铜离子得到电子,方程式为Cu2+ +2e- = Cu。根据电极反应式可知,转移0.2mol电子,生成0.1mol铜,消耗0.1mol锌,所以溶液质量增加是6.5g-6.4g=0.1g。
本题难度:一般
5、选择题 钛被称为21世纪金属。研究发现,用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图所示装置制备金属钛。下列叙述正确的是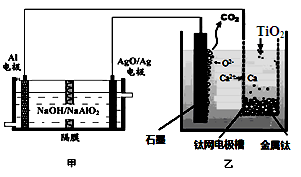
A.乙装置阴极的电极反应式为
TiO2+4e-=Ti+2O2-
B.若不考虑能量的损失,制备24.0g
金属钛,需要消耗金属铝36.0g
C.甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动
D.乙装置中的石墨电极需要定期更换
参考答案:D
本题解析:根据题给装置知,甲池为原电池,Al电极为负极,被氧化,AgO/Ag电极为正极,发生还原反应,乙为电解装置,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙与二氧化钛发生反应:2Ca+TiO2=Ti+2CaO。A、乙装置阴极的电极反应式为2Ca2++4e-═2Ca、2Ca+TiO2=Ti+2CaO,错误;B、n(Ti)=0.5mol,则消耗1molCa,转移2mol电子,由电极方程式Al+4OH---3e-═AlO2-+2H2O可知,需要2/3molAl,质量为18g,错误;C、甲装置工作过程中OH-向负极移动,即向Al极移动,错误;D、因乙装置中的石墨电极不断被消耗,则乙装置中的石墨电极需要定期更换,正确。
本题难度:一般