时间:2025-06-26 03:54:57
1、选择题 在含2 mol H2 SO4的浓H2 SO4溶液中加入足量的Zn粉,使其充分反应,则下列推断中错误的是?(?)
①放出的气体中除SO2外还有H2;
②反应结束时转移电子的总韧质的量为4 mol;
③只放出SO2气体,其物质的量为l mol;
④反应结束后加入KNO3固体,Zn粉继续溶解
A.只有①
B.只有②
C.只有③④
D.只有②③④
参考答案:D
本题解析:略
本题难度:简单
2、填空题 (1)现有以下物质:①NaCl溶液;②液态SO3;③乙醇(C2H5OH);
④熔融的KNO3;⑤BaSO4固体;⑥干冰;Cu
其中:属于电解质的是?(用序号填写)
(2)已知铜在加热条件下能与浓H2SO4反应,产物为CuSO4、SO2、H2O,写出该反
应的化学方程式__________________,其中发生氧化反应的物质是______。
参考答案:1)④⑤(2)Cu+2H2SO4(浓)  ?CuSO4+SO2↑十2H2O? ,? Cu
?CuSO4+SO2↑十2H2O? ,? Cu
本题解析:属于电解质的是④熔融的KNO3;⑤BaSO4固体;已知铜在加热条件下能与浓H2SO4反应,产物为CuSO4、SO2、H2O,该反应的化学方程式Cu+2H2SO4(浓)  ?CuSO4+SO2↑十2H2O,其中发生氧化反应的物质是Cu。
?CuSO4+SO2↑十2H2O,其中发生氧化反应的物质是Cu。
点评:水溶液中或熔融状态下能够电离的化合物称为电解质,常见的酸、碱、盐都是电解质如:碳酸、硫酸、硝酸、磷酸、乙酸(醋酸)都是酸,氢氧化钡、一水合氨、氢氧化铜都是碱,碳酸钠、碳酸钙、碳酸氢钠、硫酸铜晶体都是盐,它们都是电解质。在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质。
本题难度:一般
3、选择题 下列化学反应中,H2SO4作为氧化剂的是?(?)
A.2NaOH+H2SO4=Na2SO4+2H2O
B.C+2H2SO4(浓) △ CO2↑+2SO2+2H2O
C.BaCl2+H2SO4=BaSO4↓+2HCl
D.CuO+H2SO4=CuSO4+H2O
参考答案:B
本题解析:略
本题难度:简单
4、选择题 在氧化还原反应的过程中,氧化反应和还愿反应同时发生,有关SO2+2H2O→SO42-+4H++2e-反应的说法错误的是?(?)
A.该反应为氧化反应
B.上述反应中若产生0.1 mol SO42-,则消耗SO2的物质的量为0.1mol
C.Fe2(SO4)3、品红两种溶液都能使上述反应进行
D.通入Cl2会降低SO2的漂白作用
参考答案:C
本题解析:略
本题难度:一般
5、选择题 在过量的稀硫酸溶液中加入5.6 g Fe粉,待反应完全后,再加入50 mL0.5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为:
“?FeSO4 +?KNO3 + ?H2SO4= ?K2SO4 +?Fe2(SO4)3+?NxOy ?+ ?H2O”,则对该反应的下列说法正确的是
A.反应中还原产物是NO
B.氧化产物和还原产物的物质的量之比为1∶4
C.反应过程中转移的电子数为8e-
D.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5
参考答案:D
本题解析:设还原产物中N的化合价为a,由电子守恒可得, 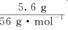 ×1=0.5 mol·L-1×50×10-3 L×(5-a),解得a=1,所以还原产物为N2O,所以A错误;由得失电子守恒和原子守恒配平化学方程式得8FeSO4+2KNO3+5H2SO4=K2SO4+4Fe2(SO4)3+N2O+5H2O,所以D正确,由化学方程式可知氧化产物和还原产物的物质的量之比为4∶1,所以B错误,反应过程中转移的电子数为0.1×6.02×1023个,所以D错误。
×1=0.5 mol·L-1×50×10-3 L×(5-a),解得a=1,所以还原产物为N2O,所以A错误;由得失电子守恒和原子守恒配平化学方程式得8FeSO4+2KNO3+5H2SO4=K2SO4+4Fe2(SO4)3+N2O+5H2O,所以D正确,由化学方程式可知氧化产物和还原产物的物质的量之比为4∶1,所以B错误,反应过程中转移的电子数为0.1×6.02×1023个,所以D错误。
点评:本题利用了电子得失守恒的原理解决了计算问题。在氧化还原反应的计算和配平中,电子得失守恒运用得很多,需要学生熟练掌握。
本题难度:一般