时间:2025-06-26 03:49:54
1、选择题 下列实验操作或装置符合实验目的是( )
A.
用酸性KMnO4溶液滴定Na2SO3
B.
配制稀硫酸溶液
C.
在铁制品上镀铜
D.
(关闭止水夹)
检查装置气密性
2、填空题 甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使得其在制药、燃料、 农药等化学工业中有许多独特的用途。
(1)已知:2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-25 kJ.mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下。
CH3OCH3(g)+H2O(g) △H=-25 kJ.mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下。 
①平衡时,c(CH3OCH3)等于____mol.L-1,反应混合物的总能量减少____kJ。
②若在平衡后的容器中再加入与起始时等量的CH3OH,请在如图中画出CH3OH的浓度和转化率随时间变化的曲线。 
(2)在直接以甲醚为燃料的电池中,电解质溶液为酸性,则负极反应式为____,正极反应式为___
(3)已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71 kJ. mol-1
②CO(g)+2H2(g)=CH3OH(l) △H=-90.5 kJ.mol-1
③CH4(g) +2O2(g)=CO2(g) +2H2O(l) △H=- 890 kJ. mol-1
则甲醇的燃烧热为___。若CO的燃烧热为282.5 kJ.mol-1,则H2的燃烧热为___。
3、选择题 下列四个图像的有关说法正确的是
A.①表示反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的△H="183" kJ·mol-1
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体
C.③表示体积和pH均相同的HCl、CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示的是HCl溶液
D.④表示10 mL 0.1 mol·L-1 Na2CO3和NaHCO3两种溶液中,分别滴加0.l mol/L HCl溶液时,CO2的体积随盐酸体积的变化,则b表示的是NaHCO3溶液
4、计算题 (8分)将锌片和银片浸入100 mL 1mol·L
5、填空题 我国首创的以铝、空气、海水为能源的新型海水标志灯已研制成功。这种灯以海水为电解质,靠空气中的氧气使铝不断氧化而产生电能,其正极电极反应式为:
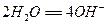 ,负极电极反应式为:
,负极电极反应式为: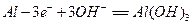 ,只要将灯放入海水中,数分钟后就会发出耀眼的光,其能量比电池高20~50倍。
,只要将灯放入海水中,数分钟后就会发出耀眼的光,其能量比电池高20~50倍。
(1)此种新型电池的负极材料是?
(2)电池总反应式为?