时间:2025-06-26 03:49:54
1、选择题 如图为铅蓄电池的示意图.下列说法正确的是( )
A.放电时,N为负极,其电极反应式为:PbO2+SO42-+4H++2e-=PbSO4+2H2O
B.放电时,c(H2SO4)不变,两极的质量增加
C.充电时,阳极反应式为:PbSO4+2e-=Pb+SO42-
D.充电时,若N连电源正极,则该极生成PbO2
2、选择题 在室温下,1L某溶液中含有的离子如下表:
| 离子 | Cu2+ | Al3+ | NO3- | Cl- C(mol/L) 1 1 4 a |
3、选择题 下列装置中,能组成原电池的是:( ) 
4、填空题 (12分)(1)已知反应Ⅰ:4NH3(g)+3O2(g)==2N2(g)+6H2O(g) △H=-1266.8kJ/mol
反应Ⅱ:N2(g) + O2(g)="=" 2NO(g) △=+180.5kJ/mol
它们的平衡常数依次为K1、K2
①写出氨高温催化氧化生成NO的热化学方程式 ,该反应的化学平衡常数的表达式K= (用含K1、K2的代数式表示)。
②反应Ⅰ可设计成燃料电池,若该电池以KOH溶液作电解质溶液,则负极的电极反应式为: 。该电池使用过程中,正极附近溶液的pH将 (填“升高”、“降低”或“不变”)。
(2)已知:N2(g) +3H2(g)  2NH3(g) △H=-92kJ/mol。
2NH3(g) △H=-92kJ/mol。
①为提高H2的转化率,宜采取的措施有 (填字母)
A.及时移出氨
B.升高温度
C.使用催化剂
D.循环利用和不断补充N2
②在一定温度、压强下,将N2和H2按体积比1:3在密闭容器中混合,当反应达平衡时,测得平衡混合气体中NH3的体积分数为25%,此时H2的转化率为 。
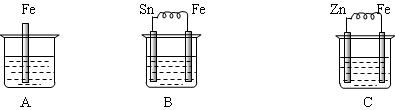
5、填空题 下图烧杯中盛有稀硫酸,则:
(1)A中进行的离子反应方程式为?。
(2)B中各电极的电极反应式:负极:?;正极: ?。
(3)C中被腐蚀的金属是?,正极反应?。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是??。