时间:2025-06-26 03:44:23
1、填空题 (10分)下图中电极a、b分别为Ag电极和P t电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
t电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答: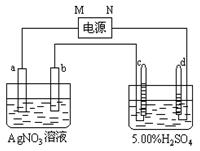
(1)直流电源 中,M为 极。
中,M为 极。
(2)写出c极上发生的电极反应式 。
(3)Pt电极上生成的物质是 ,其质量为 g。
(4)AgNO3溶液的浓度(填增大、减小或不变。) , H2SO4溶液的浓度 。( 同上)
同上)
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。
2、选择题 铜锌原电池(如图)工作时,下列叙述正确的是( )
A.正极反应为:Zn-2e-=Zn2+
B.盐桥中的K+移向ZnSO4溶液
C.电池反应为:Zn+Cu2+=Zn2++Cu
D.在外电路中,电子从负极流向正极;在电池内部,电子从正极流向负极
3、填空题 分氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是?。
(2)工业上氨气可以由氢气和氮气合成。?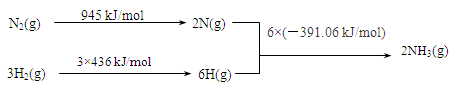
①该反应的热化学方程式是?。
②简述一种检查氨气是否泄露可采用的化学方法:?。
(3)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。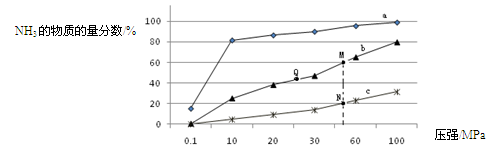
①曲线a对应的温度是?。
②关于工业合成氨的反应,下列叙述正确的是? (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③ M点对应的H2转化率是?。
(4)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用
氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶
质为?。
② (NH4)2SO3显碱性,用化学平衡原理解释?。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确
的是?(填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)?
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(5)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理: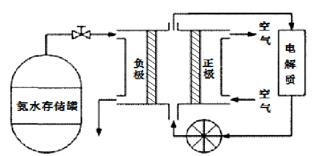
①氨气燃料电池的电解质溶液最好选择?(填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是?。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是?,正极的电极反应方是?。
4、选择题 按下图装置实验,若x轴表示流入正极的电子的物质的量,忽略溶液体积的变化;则y轴应表示
①c(Ag+) ②c(NO3-) ③a棒的质量
④b棒的质量 ⑤溶液的质量
A.①②③
B.②③⑤
C.①②④
D.仅②
5、填空题 近年来,为提高能源利用率,西方提出共生系统。特指为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:
2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的______极(填“正”或“负”),负极反应式为______________。用这种方法处理SO2废气的优点是____________________。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下 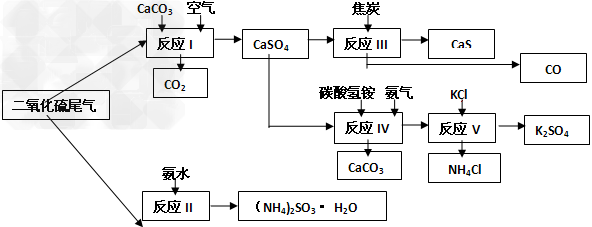
①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是____________________。
②下列有关说法正确的是_______________。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C?===?CaS+4CO↑?
C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
③?反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是_____________________。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式________________________。