时间:2025-06-26 03:44:23
1、简答题 甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
②对于反应Ⅰ,下图甲表示能量的变化;图乙表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时闻峦化。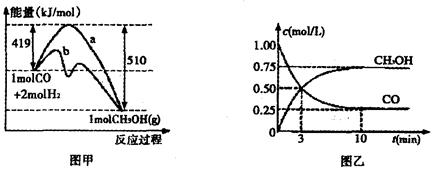
在“图甲”中,曲线__________(填:“a”或“b”)表示使用了催化剂;该反应属于________(填:“吸热”、“放热”)反应。在图乙中从反应开始到建立平衡,用H2浓度变化表示的反应速率为_____________;该温度下CO(g)+2H2(g) CH3OH(g)的化学平衡常数为__________.
CH3OH(g)的化学平衡常数为__________.
③对于反应Ⅱ,在一定温度时,将lmol CO2年和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则容器内的平衡压强与起始压强之比为__________;若容器容积不变,下列措施可增加甲醇产率的是____________。
a.升高温度
b.增加CO2的量
c.充入He,使体系总压强增大
d.按原比例再充入CO2和H2?
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种?污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程。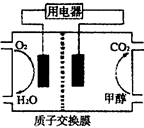
①阳极电极反应式为____________。
②除去甲醇的离子方程式为________________。
参考答案:(14分)(1)①反应I符合“原子经济性”的原则即原子利用率为100%(1分)
②b(1分)?放热(1分)? 0.15mol/(L·min)(2分)? 12(1分)③1-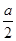 (2分)? bd(2分)
(2分)? bd(2分)
(2)①CO2+-e-=CO3+(2分)
②6 CO3++CH3OH+H2O=CO2↑+6 CO2++6H+(2分)
本题解析:(1)①根据反应I和反应Ⅱ的生成物可知,反应I中生成物只有一种,而反应Ⅱ中还有水生成,即反应I符合“原子经济性”的原则即原子利用率为100%,所以反应Ⅰ优于反应Ⅱ。
②根据图像甲可知,曲线b的活化能低于曲线a的活化能,所以曲线b表示使用了催化剂;同样根据图像甲可知,反应物的总能量高于生成物的总能量,所以反应是放热反应;根据图像乙可知,反应进行到10min是反应达到平衡状态,此时生成的甲醇浓度是0.75mol/L,则根据反应I可知,消耗氢气的浓度是1.5mol/L,所以氢气表示的反应速率是1.5mol/L÷10min=0.15mol/(L·min);平衡时氢气的浓度是2mol/L-1.5mol/L=0.5mol/L,所以根据CO和甲醇的平衡浓度可知,该温度下反应的平衡常数K=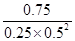 =12。
=12。
③?CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始量(mol/L)? 1? 3? 0? 0
转化量(mol/L)? a? 3a?a? a
平衡量(mol/L)? 1-a? 3-3a? a? a
则根据压强之比是相应的物质的量之比可知
容器内的平衡压强与起始压强之比为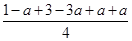 =1-
=1-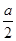
a.因正反应放热,升高温度可使平衡向逆反应方向移动,不能增加甲醇产率,故a不正确;
b.增加CO2的量,平衡向正反应方向移动,所以可以增加甲醇产率,故b正确;
c.充入He,使体系总压强增大,对于参加反应的物质来说,浓度不变,平衡不移动,甲醇产率不变,故c错误;
d.按原比例再充入CO2和H2压强增大,平衡向正反应方向移动,可以增加甲醇产率,故d正确。
答案选bd。
(2)①原电池中阳极失去电子,所以根据装置图可知,CO2+在阳极失去电子,阳极电极反应式为CO2+-e-=CO3+。
②Co3+做氧化剂,能把水中的甲醇氧化成CO2而净化,反应的离子方程式是6 CO3++CH3OH+H2O=CO2↑+6 CO2++6H+。
本题难度:一般
2、填空题 (13分)由方铅矿(PbS)制备Pb和PbO2的方法如下: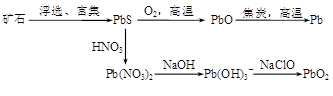
PbO与焦炭煅烧时可能会发生如下反应:
PbO(s)+C(s)=Pb(s)+CO(g)? ΔH=+108.5 kJ·mol—1? ①
PbO(s)+CO(g)=Pb(s)+CO2(g)? ΔH=-64 kJ·mol—1? ②
(1)已知Pb与O2反应的热化学方程式为:2Pb(s)+O2(g)=2PbO(s)? ΔH=-438 kJ·mol—1
则C完全燃烧的热化学方程式为?。
(2)能提高反应②中PbO转化率的措施有?(填字母)。
a.升高温度? b.增大压强? c.加入焦炭? d.加入催化剂
(3)制备过程中会产生SO2、NO、CO等有毒气体,可将它们按一定比例混合在一定条件下反应得到S、N2和CO2。若SO2与NO的体积比为1∶2,该反应的化学方程式为?。
(4)水溶液中铅的存在形态有多种,各形态的浓度分数α随溶液pH变化的关系如下图所示: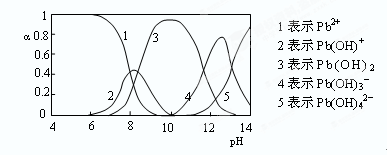
pH=6.5时,Pb2+水解的离子方程式为?;加入NaClO制备PbO2之前需先用NaOH调节溶液pH至12.5,理由是?。
参考答案:(1)C(s)+O2(g)=CO2(g)?ΔH=-393.5 kJ·mol—1?(2)c
(3)SO2+2NO+4CO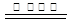 S+N2+4CO2
S+N2+4CO2
(4)Pb2++H2O Pb(OH)++H+?此时Pb(OH)3-含量最高
Pb(OH)++H+?此时Pb(OH)3-含量最高
(第(4)题每空2分,其余每空3分,共13分)
本题解析:(1)根据盖斯定律可知,①+②+③即得到C(s)+O2(g)=CO2(g) ,所以反应热ΔH=+108.5 kJ·mol—1―64 kJ·mol—1―438 kJ·mol—1=-393.5 kJ·mol—1。
(2)正反应是放热反应,升高温度平衡向逆反应方向移动,转化率降低;反应前后体积不变,改变压强平衡不移动;催化剂不能影响平衡状态;加入焦炭,能消耗CO2,降低CO2浓度,平衡向正反应方向移动,转化率增大,答案选c。
(3)根据化合价的变化可知,SO2和CO是还原剂,NO是氧化剂,所以根据电子的得失守恒可知,反应的方程式是SO2+2NO+4CO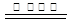 S+N2+4CO2。
S+N2+4CO2。
(4)根据图像可知,pH=6.5时,水解产物是Pb(OH)+,所以水解方程式是Pb2++H2O Pb(OH)++H+;根据图像可知,此时溶液中Pb(OH)3-含量最高,反应易于发生。
Pb(OH)++H+;根据图像可知,此时溶液中Pb(OH)3-含量最高,反应易于发生。
本题难度:一般
3、选择题 控制适合的条件,将反应Fe2++Ag+ Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是
Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是 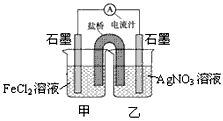
[? ]
A.反应开始时,电子从甲中石墨经导线流向乙中石墨
B.电流计指针为零时,上述反应的正反应速率等于逆反应速率
C.电流计读数为零后,在甲中加入FeCl3固体,乙中石墨电极反应为Ag - e- == Ag+
D.电流计读数为零后,在乙中加入硫化钠固体,电流计指针读数仍为零
参考答案:D
本题解析:
本题难度:一般
4、选择题 某实验兴趣小组用如图所示装置实验,其中描述不合理的是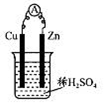
A.Zn为负极
B.H+向负极定向移动
C.化学能转化为电能
D.Cu电极反应:2H++2e-=H2↑
参考答案:B
本题解析:B:H+移动方向与电流相同,与电子方向相反。电子移动方向是Zn→Cu,所以H+应移向Cu极(正极)定向移动
本题难度:一般
5、填空题 (2分)由铜、银和硝酸银溶液组成的原电池中,负极反应式为 ,正极反应式为 。
参考答案:(2分)负极:Cu-2e— ="=" Cu2+ 正极:2Ag++2e— ="=" 2Ag
本题解析:略
本题难度:一般