时间:2025-06-26 03:38:39
1、选择题 一氧化氮与一氧化碳都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳。对此反应,下列叙述中正确的是
[? ]
A.使用催化剂能改变平衡常数
B.使用催化剂能改变反应速率
C.改变压强对反应速率没有影响
D.降低压强能加大反应速率
参考答案:B
本题解析:
本题难度:一般
2、简答题 氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2
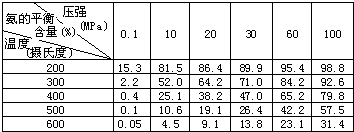
参考答案:(1)①根据化学方程式可写出平衡常数为k=c2(NH3)c(N2)?c3(H2),由于反应放热,升高温度平衡向逆反应方向移动,则平衡常数减小,
故答案为:k=c2(NH3)c(N2)?c3(H2);减小;
②200℃、100MPa时氨气的含量最大,则H2转化率最高,但实际工业生产中越强不能太大,因压强太高,对生产设备要求也高,难以实现,
故答案为:200℃、100MPa;压强太高,对生产设备要求也高,难以实现;
③A.催化剂不影响平衡移动,故A错误;
B.寻找常温下的合适催化剂可减少能量的消耗,为研究的主要方向,故B正确;
C.△S<0,需在一定温度下才能进行,故C错误;
D.增大n(N2)可提高H2的转化率,故D正确.
故答案为:BD;
(2)氨气为碱性气体,易与酸反应,所以电解质溶液应呈碱性,负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:碱性;2NH3-6e-+6OH-=N2+6H2O.
本题解析:
本题难度:一般
3、选择题 将4.0mol?PCl3 和2.0mol?Cl2 充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)?PCl5(g).达到平衡时,PCl5 为0.80mol,如果此时移走2.0mol?PCl3 和l.0mol?Cl2,在相同温度下再达平衡时PCl5 的物质的量是( )
A.0.8?mol
B.0.4?mol
C.小于0.4?mol
D.大于0.4?mol,小于0.8?mol
参考答案:达平衡后移走2.0mol?PC13和1.0mol?C12,重新到达的平衡,可以等效为开始加入2.0mol?PC13和1.0molC12到达的平衡,与原平衡相比压强减小,平衡向逆反应移动,反应物的转化率减小,故达新平衡时PC15的物质的量小于原平衡的12倍,即达平衡时PC15的物质的量小于0.8mol×12=0.4mol,
故选C.
本题解析:
本题难度:简单
4、填空题 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
(1)CO可用于合成甲醇.在体积可变的密闭容器中充入4mol CO和8mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g)
(Ⅰ)平衡时CO的转化率与温度、压强的关系如图所示:
①该反应的逆反应属于______反应;(填“吸热”或“放热”).
②在0.1Mpa、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的______倍.(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4mol CO,8mol H2,达到平衡时CO转化率______(填“增大”,“不变”或“减小”),平衡常数K______(填“增大”,“不变”或“减小”).
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法.已知:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ?mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ?mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:______.
(3)在反应(Ⅰ)中制得的CH3OH即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液.则该燃料电池放电时:负极的电极反应式为______.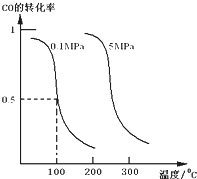
参考答案:(1)①图象分析,一氧化碳的转化率随温度升高减小,正反应为放热反应,逆反应为吸热反应;
故答案为:吸热;
②0.1Mpa、100℃的条件下,一氧化碳的转化率为0.5,消耗一氧化碳物质的量为4mol×0.5=2mol,依据平衡三段式得到;
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 4 8 0
变化量(mol) 2 4 2
平衡量(mol) 2 4 2
则反应达到平衡时容器体积和开始容器体积之比:V(平):V(起)=n(平):n(起)=8:12=0.67
反应达到平衡时容器体积为开始容器体积的0.67倍;
故答案为:0.67;
③在温度和容积不变的情况下,再向平衡体系中充入4mol CO,8mol H2,为保持恒压体积增大,最后达到平衡状态和原来平衡状态相同,达到平衡时CO转化率不变;平衡常数随温度变化,温度不变,平衡常数不变;
故答案为:不变,不变;
(4)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ?mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ?mol-1
依据盖斯定律计算,①×2-②则CH4和H2O(g)反应生成CO2和H2的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ?mol-1;
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ?mol-1;
(5)CH3OH即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液.则该燃料电池放电时是原电池,负极上是甲醇失电子发生氧化还原反应生成碳酸盐,反应的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
本题解析:
本题难度:一般
5、选择题 下列叙述中正确的是(? )
A.某反应的平衡常数仅是温度的函数,其数值大小与该反应的焓变(△H)无关
B.催化剂不能改变平衡常数的大小,平衡常数越大,反应一定越容易进行
C.对于一个处于平衡状态的化学反应来说,平衡常数发生变化,化学平衡不一定发生移动
D.化学平衡发生移动,平衡常数不一定发生变化
参考答案:A
本题解析:
本题难度:简单