时间:2025-06-26 03:38:39
1、选择题 一氧化氮与一氧化碳都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳。对此反应,下列叙述中正确的是
[? ]
A.使用催化剂能改变平衡常数
B.使用催化剂能改变反应速率
C.改变压强对反应速率没有影响
D.降低压强能加大反应速率
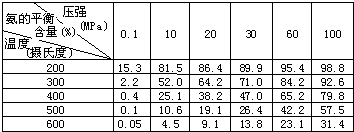
2、简答题 氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2
3、选择题 将4.0mol?PCl3 和2.0mol?Cl2 充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)?PCl5(g).达到平衡时,PCl5 为0.80mol,如果此时移走2.0mol?PCl3 和l.0mol?Cl2,在相同温度下再达平衡时PCl5 的物质的量是( )
A.0.8?mol
B.0.4?mol
C.小于0.4?mol
D.大于0.4?mol,小于0.8?mol
4、填空题 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
(1)CO可用于合成甲醇.在体积可变的密闭容器中充入4mol CO和8mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g)
(Ⅰ)平衡时CO的转化率与温度、压强的关系如图所示:
①该反应的逆反应属于______反应;(填“吸热”或“放热”).
②在0.1Mpa、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的______倍.(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4mol CO,8mol H2,达到平衡时CO转化率______(填“增大”,“不变”或“减小”),平衡常数K______(填“增大”,“不变”或“减小”).
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法.已知:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ?mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ?mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:______.
(3)在反应(Ⅰ)中制得的CH3OH即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液.则该燃料电池放电时:负极的电极反应式为______.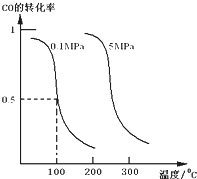
5、选择题 下列叙述中正确的是(? )
A.某反应的平衡常数仅是温度的函数,其数值大小与该反应的焓变(△H)无关
B.催化剂不能改变平衡常数的大小,平衡常数越大,反应一定越容易进行
C.对于一个处于平衡状态的化学反应来说,平衡常数发生变化,化学平衡不一定发生移动
D.化学平衡发生移动,平衡常数不一定发生变化