时间:2025-06-26 03:36:14
1、填空题 二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200℃连续反应24小时,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2离子方程式为 。
(2)用水洗涤时,如何证明S042-己除尽 。
(3)己知1.20gFeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52kJ热量,FeS2燃烧反应的热化学方程式为 。
(4)取上述制得的正极材料1.1200g (假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.8000g红棕色固体,则该正极材料中FeS2的质量分数(写出计算过程)。
。
2、填空题 (16分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题: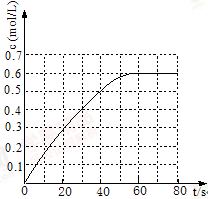
①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变; B.混合气体的颜色不再变化; C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。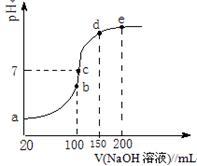
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
3、计算题 1 mol CH4气体完全燃烧放出的热量为802kJ,但当不完全燃烧生成CO气体和液态H2O时,放出的热量为
519kJ。如果1mol CH4与ng O2燃烧生成CO、CO2气体和液态H2O,放出731.25 kJ热量。
(1)写出CH4气体不完全燃烧的热化学方程式。
(2)计算n的值。
4、选择题 研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3、NO的体积比保持不变
D.每消耗 1 mol SO2,同时生成1 mol NO
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为 ;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为 。
5、填空题 (8分)以钛酸亚铁(FeTiO3)为原料制取BaTiO3的过程如下图所示: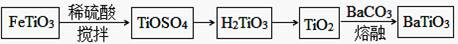
(1)FeTiO3与稀硫酸反应,产物有TiOSO4、H2O和 (填化学式)。
(2)已知:TiO2(s)+H2SO4(aq)=TiOSO4(aq)+H2O (l) △H=akJ·mol-1
H2TiO3(s)=TiO2(s)+H2O (l) △H=b kJ·mol-1
写出TiOSO4水解生成H2TiO3的热化学方程式 。
(3)写出TiO2生成BaTiO3的化学方程式 。