时间:2025-06-26 03:36:14
1、简答题 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯.
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ-mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ-mol-1
则相同条件反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=______kJ-mol-1
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol?H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
①反应的热化学方程式为______.
②又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是______kJ.
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______.
参考答案:(1)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ?mol-1
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ?mol-1
依据盖斯定律①-②得到:C3H8(g)→CH3CH=CH2(g)+H2(g)△H=124.2KJ/mol;
故答案为:124.2;
(2)①把0.4mol液态肼和0.8mol?H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量;写出化学方程式,计算1mol肼反应放热640KJ;依据热化学方程式书写方法写出的化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640?kJ?mol-1,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640?kJ?mol-1;
②①N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640?kJ?mol-1
②H2O(l)=H2O(g)△H=+44kJ/mol
依据盖斯定律①-4×②得到N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-816kJ?mol-1
依据热化学方程式计算,16g液态肼与液态双氧水反应生成液态水时放出的热量是404kJ,
故答案为:404;
③产物是氮气和水,生成产物无污染,故答案为:产物不会造成环境污染.
本题解析:
本题难度:一般
2、填空题 已知两个反应式:
CH≡CH(g) +H2 (g) → CH2= CH2 (g) ; △H =-174kJ·mol-1
CH≡CH(g) +2H2 (g) → C2H6(g); △H =-311kJ·mol-1
则CH2= CH2(g) +H2(g) → C2H6 (g) 的反应热为
参考答案:-137kJ/mol
本题解析:根据盖斯定律可知,②-①即得到CH2= CH2(g) +H2(g) C2H6 (g),所以该反应的反应热△H=-311kJ/mol+174kJ/mol=-137kJ/mol。
C2H6 (g),所以该反应的反应热△H=-311kJ/mol+174kJ/mol=-137kJ/mol。
考点:考查反应热的计算
点评:该题是高考中的常见题型和重要的考点,属于基础性试题的考查。主要是考查学生对盖斯定律的了解掌握程度,以及灵活运用盖斯定律解决实际问题的能力。
本题难度:一般
3、填空题 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题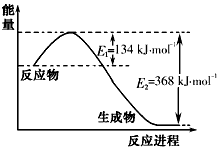
(1)上图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________________。
(2)在定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与t的关系如下表
2NH3(g),其化学平衡常数K与t的关系如下表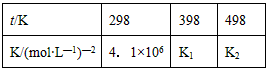
请完成下列问题:
①写出该反应的平衡常数表达式:K=_________________ 试比较K1、K2的大小,K1________K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是_______________(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.3v(N2)(正) = v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
③若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度_____________(填增大或减小,下同),NH3的体积分数____________________。
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_____________________。
参考答案:(1)NO2(g)+CO(g)==CO2(g)+NO(g) △H=-234kJ·mol-1
(2)①K=C2(NH3)/C(N2)×C3(H2);>;②BC;③增大;增大
(3)①N2H62++H2O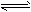 [N2H5·H2O]++H+
[N2H5·H2O]++H+
本题解析:
本题难度:一般
4、选择题 已知:①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1.下列说法中错误的是( )
A.①式表示25℃,101?kpa时,2?mol?H2和1?mol?O2完全燃烧生成2?mol?H2O(l)放热571.6?kJ
B.2H2(g)+O2(g)=2H2O(g)中△H大于-571.6?kJ?mol-1
C.将含1?mol?NaOH的水溶液与50?g?98%的硫酸溶液混合后放出的热量为57.3?kJ
D.将含1?mol?NaOH的稀溶液与含1?mol?CH3COOH的稀溶液混合后放出的热量小于57.3?kJ
参考答案:C
本题解析:
本题难度:简单
5、填空题 (11分)(1)已知:①Fe(s)+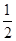 O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+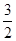 O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。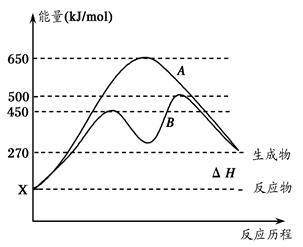
①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+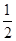 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
参考答案:(11分)
(1)3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1(2分)
不能(1分) 该反应为引发反应,需消耗大量能量,成本高(2分)
(2)吸(1分) 增大(1分) D (2分)
(3)409kJ/mol(2分)
本题解析:(1)根据盖斯定律Al与FeO的反应的热效应ΔH=②-3①=-1675.7 kJ·mol-1-3(-272.0 kJ·mol-1)=-859.7kJ/mol,所以该反应的热化学方程式为3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1;该反应不能用于工业炼铁,因为用该反应炼铁时需消耗大量冶炼成本更高的Al,消耗大量能量,成本高,无经济效益;
(2)①该反应的反应物的总能量低于生成物的总能量所以是吸热反应;升高温度,正逆反应的速率都增大;②B的历程说明,没改变反应热,但降低了该反应的活化能,所以是使用了催化剂,答案选D;
(3)活化能是反应物的总能量与反应时的最高能量的差值,逆反应的反应物即正反应的生成物,所以逆反应的活化能=正反应的活化能+逆反应的反应热=167.2+241.8=409kJ/mol。
考点:考查盖斯定律的应用,活化能的计算
本题难度:一般