时间:2025-06-26 03:34:37
1、填空题 短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为?;W的电子式 ?。
(2)已知:①2E → E-E; =-a kJ·mol-1?② 2A → A-A;
=-a kJ·mol-1?② 2A → A-A; =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E; =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式?。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g); =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | 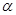 1 1 | 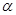 2 2 | 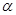 3 3 |
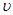 ( A2)为?。
( A2)为?。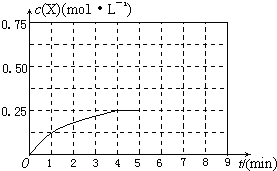
参考答案:(1)离子键、共价键(1分)(1分)
(2)H2(g)+Cl2(g)=2HCl(g);△H=(a+b-2c)kJ·mol-1(2分)
(3)①0.125mol·L-1·min-1(2分)?② 4(2分)?③ C(2分)?④ ABD(2分)
(4)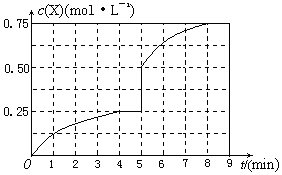 (2分)
(2分)
本题解析:A是周期表中原子半径最小的元素,即为H,B是形成化合物种类最多的元素,即为C
,C是自然界含量最多的元素,即为O,D是同周期中金属性最强的元素,即为Na,E的负一价离子与C的某种氢化物分子W含有相同的电子数,由于E的原子序数最大,则E即为Cl,因此W是双氧水。
(1)A、C、D形成的化合物是氢氧化钠,其中含有的化学键类型为:离子键、共价键;双氧水分子中含有极性键和非极性键,属于共价化合物,因此双氧水的电子式为 。
。
(2)已知①Cl-Cl→2Cl;△H=+a?kJ?mol-1、②2H→H-H;△H=-b?kJ?mol-1、③Cl+H→HCl;△H=-c?kJ?mol-1,所以依据盖斯定律可知H2(g)+Cl2(g)=2HCl(g)可以是①-②+③×2得到的,因此反应的焓变△H=-(2c-a-b)kJ/mol。
(3)①2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
初始量:2?1? 0
变化量:1?0.5?0.5
平衡量:1?0.5?0.5
在该温度下,A2的平均反应速率v(A2)=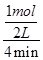 =0.125?mol?L-1?min-1;
=0.125?mol?L-1?min-1;
②化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该温度下,反应2H2(g)+CO(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=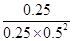 =4mol-2?L2;
=4mol-2?L2;
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,则A、平衡时各种物质的浓度或物质的量不再发生变化,但它们之间的物质的量不一定相等或满足某种关系,因此容器内A2、BC、X的物质的量之比为2:1:1不能说明达到平衡状态,A不正确;B、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内气体的密度保持恒定不能说明反应达到平衡状态,B不正确;C、容器内A2气体的体积分数保持恒定可以说明反应达到平衡状态,C正确;D、2V正(A2)=V逆(BC)说明二者的反应速率方向是相反的,但不能满足反应速率之比是相应的化学计量数之比,不能说明反应达到平衡状态,D不正确,答案选C。
④A、投料2molH2、1molCO和1molCH4O建立的平衡是等效的,只是建立的方向不一样,所以α1+α2=1,故A正确;B、料2molH2、1molCO和1molCH3OH建立的平衡是等效的,反应2H2(g)+CO(g)?CH3OH(g)是放热的,放出的热量应该是Q1+Q2=a,故B正确;C、当氢气和一氧化碳的投料增加一倍,则压强会增大,导致化学平衡正向移动,移动的结果是反应物的转化率增大,即α3>α1,故C错误;D、投料2molH2、1molCO和1molCH3OH建立的平衡是等效的,所以P1=P2,当氢气和一氧化碳的投料增加一倍,则压强应是增大一倍,但是压强增大,导致化学平衡正向移动,移动的结果是压强比原来的2倍要小,即P3<2P1=2P2,故D正确;E、当氢气和一氧化碳的投料增加一倍,能量变化数值理论上也应该是原来的2倍,但是压强引起化学平衡正向,而正向放热,结果使得Q3>2Q1,故E错误。选ABD。
(4)将甲容器的体系体积压缩到1L,若在第8min 达到新的平衡时,则
2H2(g)+CO(g) CH4O(g)
CH4O(g)
初始量:2?1?0
变化量:1.5? 0.75?0.75
平衡量:0.5?0.25?0.75
所以达到平衡时,甲醇的物质的量浓度是0.75mol/L,在第5min时,由于体积减半,所以甲醇的浓度应该加倍,即为0.25mol/L×2=0.5mol/L,所以5-8min内,甲醇的物质的量浓度从0.5mol/L升高到0.75mol/L,如图所示: ?。
?。
本题难度:困难
2、填空题 (2分)如果反应物的总能量小于生成物的总能量,该反应为 反应(填“吸热”或“放热”,下同),盐酸和氢氧化钠的反应属于 反应。
参考答案:吸热、放热
本题解析:略
本题难度:一般
3、选择题 共价键、离子键都是构成物质微粒间的不同相互作用,同时含有上述两种相互作用是?
A.CO2
B.NaOH
C.Na2O2
D.NH4Cl
参考答案:BCD
本题解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。据此可知,A中只有共价键,BCD中既有离子键,还有共价键,答案选BCD。
点评:该题是基础性试题的考查,也是高考中的常见题型和考点,侧重对学生基础知识的巩固和训练,有助于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确化学键的概念,然后灵活运用即可。
本题难度:简单
4、填空题 (16分)我国在青藏高原发现了名为“可燃冰”的环保型新能源。
(1)“可燃冰”属于化石燃料,主要成分是CH4。另外还有两种化石燃料,它们的名称分别是 和 。
(2)CH4可与Cl2反应,反应历程如下
①Cl—Cl→2Cl· ; ΔH=" +243" kJ·mol-1
②Cl·+CH3—H→·CH3+H—Cl ; ΔH="+" 4 kJ·mol-1
③·CH3+Cl—Cl→CH3——Cl+Cl· ; ΔH=" -106" kJ·mol-1
则CH4与Cl2反应生成CH3—Cl(g)的热化学方程式为 。
(3)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如下图所示: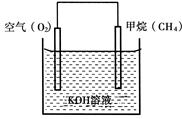
则通入CH4的一极为原电池的 (填“正极”或“负极”),正极的电极反应式为 。
(4)下图表示某些化工生产的流程(有的反应条件和产物已略去)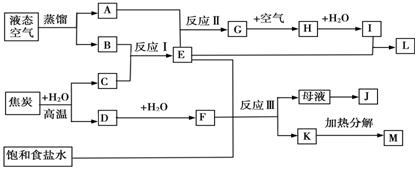
请回答下列问题:
(a)流程中所涉及的化学工业 (写出两个即可)。
(b)反应I需在500℃进行,主要原因是 ;实际工业生产中,反应Ⅱ的条件是 。
(c)工业上,析出K后,再向母液中继续通入E,并加入细小食盐颗料,其目的是 。
参考答案:(16分)
(1)煤(1分) 石油(1分)
(2)CH4(g)+Cl2(g)→CH3Cl(g)+HCl(g) ; △H =" -102" kJ·mol-1
本题解析:
本题难度:一般
5、选择题 下列各组化合物分子中,键角大小顺序正确的是(?)
A.BeCl2>BF3>CH4>NH3
B.CH4>NH3=BF3>BeCl2
C.BeCl2>BF3=NH3>CH4
D.NH3>CH4>BeCl2>BF3
参考答案:A
本题解析:氯化铍是直线型结构,键角是180°,BF3是平面三角形结构,键角是120°,甲烷是正四面体型结构,键角是109°28〞,氨气是三角锥形结构,键角是107°,所以答案选A。
点评:该题是识记性知识的考查,主要是考查学生对常见分子空间构型的熟悉了解程度,旨在巩固基础,提高学生的应试能力,难度不大,记住即可。
本题难度:一般