时间:2025-06-26 03:28:45
1、选择题 绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列制备环氧乙烷的反应中,原子利用率最高的是
[? ]
A.CH2=CH2+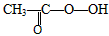 (过氧乙酸)→
(过氧乙酸)→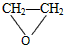 +CH3COOH
+CH3COOH
B.CH2=CH2+Cl2+Ca(OH)2→ +CaCl2+H2O
+CaCl2+H2O
C.2CH2=CH2+O2
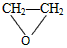
D.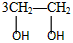

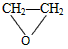 +HOCH2CH2-O-CH2CH2OH+2H2O
+HOCH2CH2-O-CH2CH2OH+2H2O
2、实验题 (12分)CoCl2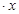 H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2
H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2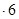 H2O的一种新工艺流程如下图:?
H2O的一种新工艺流程如下图:?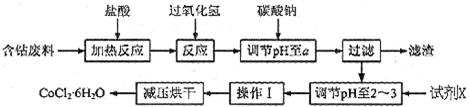
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2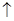
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | 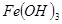 | 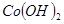 | 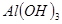 |
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
3、选择题 下列有关工业上制硫酸和氨气的说法不正确的是
A.硫酸工业中制SO3的反应条件是:高温、高压、催化剂
B.合成氨气的条件是:400—500 ℃、10Mpa —30 MPa、铁触媒
C.都进行了循环操作
D.都有热交换装置
4、选择题 环境污染已经成为人类社会面临的重大威胁,下列对应关系不正确的是
A.A
B.B
C.C
D.D
5、填空题 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol ? N2(g)+3H2(g)
? N2(g)+3H2(g) 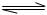 2NH3(g);△H= -92.4kJ/mol
2NH3(g);△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H= -483.6kJ/mol
氨气经催化氧化生成一氧化氮气体和水蒸气反应的热化学方程式为?。
(2)在容积固定的密闭容器中发生上述氨气的催化氧化反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | ? 0.8 | ? 1.6 | ? 0 |
| 第2min | ? 0.6 | ? a | ? 0.2 |
| 第4min | ? 0.3 | ? 0.975 | ? 0.5 |
| 第6min | ? 0.3 | ? 0.975 | ? 0.5 |
| 第8min | ? 0.54 | ? 0.9 | ? 0.56 |