时间:2025-06-26 03:28:45
1、选择题 绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列制备环氧乙烷的反应中,原子利用率最高的是
[? ]
A.CH2=CH2+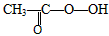 (过氧乙酸)→
(过氧乙酸)→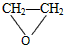 +CH3COOH
+CH3COOH
B.CH2=CH2+Cl2+Ca(OH)2→ +CaCl2+H2O
+CaCl2+H2O
C.2CH2=CH2+O2
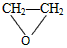
D.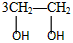

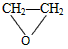 +HOCH2CH2-O-CH2CH2OH+2H2O
+HOCH2CH2-O-CH2CH2OH+2H2O
参考答案:C
本题解析:
本题难度:简单
2、实验题 (12分)CoCl2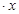 H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2
H2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份。以含钴废料(含少量Fe、Al等杂质)制取CoCl2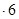 H2O的一种新工艺流程如下图:?
H2O的一种新工艺流程如下图:?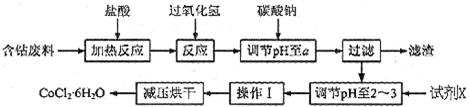
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2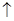
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | 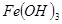 | 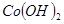 | 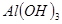 |
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
参考答案:(1)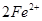
 ?(2)5.2~7.6
?(2)5.2~7.6
(3)盐酸?(4)蒸发浓缩、冷却结晶?(5)降低烘干温度,防止产品分解
本题解析:(1)要制取制取CoCl2 H2O,就必须除去溶液中的杂质离子,因此双氧水的作用是将亚铁离子氧化生成铁离子,易于以氢氧化铁的形式沉淀而除去,方程式为2Fe2+H2O2+2H+=2Fe3+2H2O。
H2O,就必须除去溶液中的杂质离子,因此双氧水的作用是将亚铁离子氧化生成铁离子,易于以氢氧化铁的形式沉淀而除去,方程式为2Fe2+H2O2+2H+=2Fe3+2H2O。
(2)根据表中数据可知,当pH大于7.6是开始析出氢氧化钴沉淀,所以pH不能大于7.6。而氢氧化铝的沉淀分为是3.4~5.2,所以a的分为是5.2~7.6。
(3)因为不能引入新的杂质,所以应该用盐酸酸化,即X是盐酸。
(4)要得到晶体,需要蒸发浓缩、冷却结晶,最后过滤即可。
(5)因为氯化钴晶体受热以分解,所以需要降低烘干温度,防止产品分解。
本题难度:一般
3、选择题 下列有关工业上制硫酸和氨气的说法不正确的是
A.硫酸工业中制SO3的反应条件是:高温、高压、催化剂
B.合成氨气的条件是:400—500 ℃、10Mpa —30 MPa、铁触媒
C.都进行了循环操作
D.都有热交换装置
参考答案:A
本题解析:A选项中SO2与O2常温常压下就可以反应,只是反应速率低了,转化率也低,加压降温有利于反应的发生。工业上制取SO3来制硫酸是,主要利用V2O5做催化剂,来催化氧化。由于加压需要一定的成本,且V2O5催化有较好的效果,所以一般不再加压和降温。B选项的条件正确。A、B的反应都需要循环操作和热交换装置来降低成本,所以C、D正确。
点评:本题结合生产实际,有时候符合化学原理的反应的条件不一定利用在实际中,因为还要考虑成本等因素,本题属于简单题。
本题难度:一般
4、选择题 环境污染已经成为人类社会面临的重大威胁,下列对应关系不正确的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:根据二氧化硫、氮氧化物导致酸雨,二氧化碳导致温室效应,聚乙烯材料导致白色污染,氮氧化物、碳氢化合物导致光化学烟雾进行判断.
解答:A.二氧化硫、氮氧化物遇到水能生成酸,是形成酸雨的主要污染物,故A正确;
B.二氧化碳是形成温室效应的主要污染物,导致臭氧空洞的物质主要是氟利昂,故B错误;
C.形成白色污染的主要原因是聚乙烯材料的污染,故C正确;
D.二氧化氮、碳氢化合物是形成光化学烟雾的主要污染物,故D正确;
故选B.
点评:本题考查化学污染知识,题目难度不大,本题注意常见化学污染名词以及形成的主要原因,学习中注意积累.
本题难度:简单
5、填空题 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol ? N2(g)+3H2(g)
? N2(g)+3H2(g) 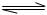 2NH3(g);△H= -92.4kJ/mol
2NH3(g);△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H= -483.6kJ/mol
氨气经催化氧化生成一氧化氮气体和水蒸气反应的热化学方程式为?。
(2)在容积固定的密闭容器中发生上述氨气的催化氧化反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | ? 0.8 | ? 1.6 | ? 0 |
| 第2min | ? 0.6 | ? a | ? 0.2 |
| 第4min | ? 0.3 | ? 0.975 | ? 0.5 |
| 第6min | ? 0.3 | ? 0.975 | ? 0.5 |
| 第8min | ? 0.54 | ? 0.9 | ? 0.56 |
参考答案:(1)4NH3(g)+5O2(g) 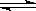 4NO(g)+6H2O (g);ΔH=-905kJ·mol—1?(3分)
4NO(g)+6H2O (g);ΔH=-905kJ·mol—1?(3分)
(2)①可增大NH3的转化率(2分)? ②0.1875 mol/(L·min) (2分)?
③使用催化剂(2分)?升高温度(2分) ?
④增加NH3的浓度,(2分)
因为6min后平衡向正反应方向移动,而NH3的浓度又增大了。(1分)
本题解析:略
本题难度:一般