时间:2025-06-26 03:21:29
1、选择题 某电解质溶液pH=a,向其中插入两根惰性电极通电一段时间后再测知溶液的pH=b,若b≤a,该电解质可能是
[? ]
A.Na2S
B.CuSO4
C.NaCl
D.Na2SO4
2、选择题 某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4?(NH4)2SO4?6H2O]处理,反应后铁元素和铬元素完全转化为沉淀.该沉淀经干燥后得到nmolFeO?FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁的物质的量为n(2-x)mol
B.处理废水中的Cr2O72-的物质的量为
| nx 2 |
3、选择题 如图所示是根据图甲的电解池进行电解时,某个量(纵坐标x)随时间变化的函数图象(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x表示( )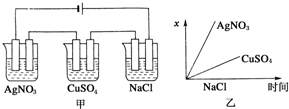
A.各电解池析出气体的体积
B.各电解池阳极质量的增加量
C.各电解池阴极质量的增加量
D.各电极上放电的离子总数
4、选择题 电解水制取H2和O2时,为了增强溶液的导电性,常常要加入一些电解质,最好选用下列物质中的
[? ]
5、选择题 钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。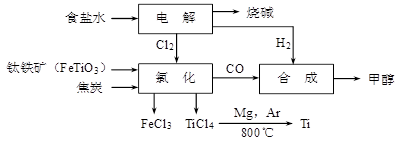
请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图_______。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)氯碱厂获得Cl2的离子方程式为
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |