时间:2025-06-26 03:20:39
1、填空题 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为CrO42-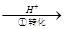 Cr2O72-
Cr2O72-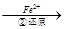 Cr3+
Cr3+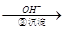 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42- (黄色)+2H+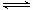 Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O
(1)若平衡体系的pH=2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是__________。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) 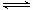 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法。该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为__________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)_________________________________。溶液中同时生成的沉淀还有__________。
2、简答题 (14分)化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体.被称之为“未来能源”。在25℃、101 kPa下,1g甲烷完全燃烧生成和液态水时放热55.6 kJ。甲烷燃烧的热化学方程式为 ______:相同条件下,356 g可燃冰(分子式为CH4·9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_______kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制各二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)
3、填空题 可逆反应:aA(g) + bB(g)  cC(g) + dD(g) ΔH=Q;根据图回答:
cC(g) + dD(g) ΔH=Q;根据图回答:
①压强 P1比P2 填(大或小)
② (a +b)比(c +d) 填(大或小)
③温度t1℃比t2℃ (高或低)
④ Q值为 填(正或负)(正值表示正反应吸热,负值表示正反应放热)
4、选择题 二氧化氮存在下列平衡:2NO2 N2O4 ΔH<0,在测定NO2的相对分子质量时,下列条件中较为适宜的是
N2O4 ΔH<0,在测定NO2的相对分子质量时,下列条件中较为适宜的是
A.温度130 ℃、压强 3.03×105 Pa
B.温度130 ℃、压强5.05×104 Pa
C.温度25 ℃、压强1.01×105 Pa
D.温度0 ℃、压强5.05×104 Pa
5、选择题 高温下,反应CO2+H2