时间:2025-06-26 03:18:11
1、计算题 下图是超导化合物----钙钛矿晶体中最小重复单元(晶胞)的结构。请回答: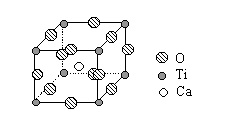
(1)该化合物的化学式为?。
(2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有?个。
(3)设该化合物的式量为M,密度为ag/cm3,阿伏加德罗常数为NA,则晶体中钙离子与钛离子之间的最短距离为?。
2、选择题 已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为
[? ]
A.直线形
B.平面正方形
C.正四面体形
D.正八面体形
3、选择题 下列有关晶体的叙述中,错误的是(?)
A.在SiO2晶体中,每个Si原子与4个O原子形成共价键
B.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
C.NaCl晶体中与每个Na+距离相等且最近的Cl—有6个;
D.CsCl晶体中与每个Cs+距离相等且最近的Cl—有8个
4、填空题 (6分) 有下列物质①铁?②干冰?③金刚石?④水晶?⑤氯化钠?⑥碘?⑦氢氧化钠,用编号填写下列空格。
(1)离子晶体有?,分子晶体有?,原子晶体有?;
(2)已知微粒间作用力包括化学键及分子间作用力。上述物质所含的微粒间作用力中,仅有共价键的有?,仅有离子键的有?,既含共价键又含离子键的有?;
5、选择题 氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.以上说法都不正确