时间:2025-06-26 03:17:23
1、选择题 在一定的温度下,下表中的某种物质在2L的密闭容器中发生化学反应,每隔一段时间对该容器内的物质进行分析,得到如下表所示的数据。已知N2O4 2NO2 △H>0,则下列说法正确的是
2NO2 △H>0,则下列说法正确的是 
[? ]
A.升高温度能使该化学平衡逆向移动
B.80 s前该反应一定没有达到平衡状态
C.20 s到40 s内用N2O4表示的反应速率为0.010 mol.L-1.s-1
D.a的值为0. 56
2、选择题 反应mA(g)+B(g)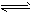 nC(g);△H=Q kJ/mol。在不同温度(T1和T2)及压强(p1和P2)下,产物C的物质的量n(C)与反应时间t的关系如图所示,下述判断正确的是
nC(g);△H=Q kJ/mol。在不同温度(T1和T2)及压强(p1和P2)下,产物C的物质的量n(C)与反应时间t的关系如图所示,下述判断正确的是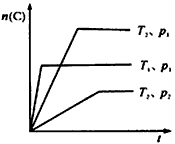
[? ]
A.Q>0
B.P1<P2
C.T1<T2
D.m≥n
3、选择题 反应2A(g)+B(g)  2C(g);△H >0。下列反应条件有利于生成C的是
2C(g);△H >0。下列反应条件有利于生成C的是
[? ]
A.低温、低压
B.低温、高压
C.高温、高压
D.高温、低压
4、选择题 在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:
2HI(g) I2(g)+H2(g) △H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
I2(g)+H2(g) △H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
[? ]
A.保持容器体积不变,升高温度,混合气体的颜色逐渐变浅
B.保持容器体积与温度不变,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大
C.保持温度不变,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=25mol/L
D.保持容器压强和温度不变,再通入2molHI气体,到达平衡状态后,测得HI的转化率为60%
5、选择题 已知:H2(g)+I2(g)?2HI(g);△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度
B.甲中加入0.1molHe,乙不变
C.甲降低温度,乙不变
D.甲增加0.1molH2,乙增加0.1molI2