时间:2025-06-26 03:17:23
1、选择题 T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
[? ]
A.T ℃时,该反应的化学方程式为:X(g)+Y(g)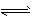 2Z(g),平衡常数K=4
2Z(g),平衡常数K=4
B.平衡时X、Y的转化率相同
C.达到平衡后,恒温将容器体积扩大为3 L,平衡向逆反应方向移动
D.T ℃时,若起始时X为0.60mol,Y为1.00 mol,则平衡时Y的转化率小于80%
参考答案:D
本题解析:
本题难度:一般
2、选择题 在一个固定容积的密闭容器中充入2molNO2,一定温度下建立如下平衡:2NO2
N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol?N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是( )
A.x>y
B.x<y
C.x=y
D.不能确定
参考答案:第一次达平衡后,再加入N2O4,N2O4的反应速率增大,因该容器是一个固定容积的密闭容器,所以加入N2O4后,反应体系的压强增大;增大压强,化学平衡向气体体积减小的方向移动,所以平衡向正反应方向移动,NO2的转化率增大,NO2的物质的量减小,体积分数也减小,故x>y.
故选A.
本题解析:
本题难度:一般
3、填空题 830K时,在密闭容器中发生下列可逆反应: CO(g)+H2O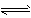 (g)CO2(g)+H2(g)△H<0
(g)CO2(g)+H2(g)△H<0
试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=_________________
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态__________________ (填“是”与“否”),此时v(正)____________ v(逆)(填“大于”“小于”或“等于”).
(3)若降低温度,该反应的K值将_____________ ,该反应的化学反应速率将______________________ (均填“增大”“减小”或“不变”)。
参考答案:(1)1
(2)否;大于
(3)增大;减小
本题解析:
本题难度:一般
4、选择题 对于可逆反应2SO2(g)+O2(g)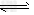 2SO3(g)?△H<0,下列研究目的和图示相符的是
2SO3(g)?△H<0,下列研究目的和图示相符的是
[? ]
A.压强对反应的影响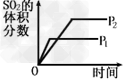
B.温度对反应的影响
C.增加氧气浓度对反应的影响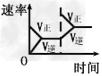
D.浓度对平衡常数的影响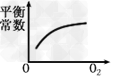
参考答案:C
本题解析:
本题难度:一般
5、选择题 在新制的氯水中存在下列平衡:Cl2+H2O?H++Cl-+HClO,若向氯水中加入少量Na2CO3粉末,溶液中发生的变化是( )
A.pH增大,HClO浓度减小
B.pH减小,HClO浓度增大
C.pH增大,HClO浓度增大
D.pH减小,HClO浓度减小
参考答案:在化学平衡中:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,会和溶液中的盐酸反应平衡正向进行,次氯酸酸性小于碳酸,不与碳酸钠反应,次氯酸浓度增大,溶液PH增大;
故选C.
本题解析:
本题难度:一般