时间:2025-06-26 03:14:56
1、选择题 下列事实不能用勒沙特列原理解释的是
A.往H2S溶液中加碱,有利于S2-增多
B.500℃左右比室温更利于氨的合成
C.使用V2O5作催化剂可加快SO2转化为SO3的速率
D.醋酸溶液与锌反应放出H2,加入适量醋酸钠晶体可以减慢放出H2的速率
参考答案:BC
本题解析:
【错解分析】漏选B或C
【正解】勒沙特列原理又称化学平衡移动原理,其研究对象是平衡移动,因此只要涉及平衡移动即可解释。选项C的叙述完全正确,但是它是针对反应速率而言、与该原理毫无关系,不应漏选。选项B中的温度与上一题有类似情况,它受反应速率、催化剂工作温度和平衡移动有关,恰好温度影响又不利平衡移动,因此也不能用勒沙特列原理解释。
本题难度:简单
2、选择题 密闭容器中,反应2X(g) Y(g)+Z(s)已达到平衡,下列叙述正确的是(?)?
Y(g)+Z(s)已达到平衡,下列叙述正确的是(?)?
A.若升高温度,X(g)的浓度增大,则正反应为吸热反应
B.若容器体积不变,在平衡混合物中加入少量Z(s),则平衡向左移动
C.压强变化对该平衡没有影响
D.若容器体积不变,加入氦气平衡不移动
参考答案:D
本题解析:略
本题难度:简单
3、填空题 (8分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
参考答案:(1)K=_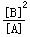 _。
_。
(2) _放热_(填“吸热”或“放热”)反应。
(3)减小__(填“增大”、“减小”或“不变”,下同),_增大____。
(4)不移动(填“向左”、“向右”、“不移动”),增大A的浓度 _,__B
本题解析:略
本题难度:一般
4、简答题 在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如表格:
| 时间/s 浓度mol?L-1 | 0 | 20 | 40 | 60 | 80 | 100 c(N2O4)mol?L-1 0.100 c1 0.050 c3 a b c(NO2)/mol?L-1 0.000 0.060 c2 0.120 0.120 0.120 |
参考答案:(1)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
?N2O4?
?2 NO2,
浓度变化:0.06mol/L? 0.120mol/L
所以平衡时N2O4的转化率为0.06mol/L0.1mol/L×100%=60%;
c3=0.1mol/L-0.06mol/L=0.04mol/L,
由表可知,40s时,c(N2O4?)=0.050mol/L,
? N2O4? 
? ?2 NO2,
浓度变化:(0.1-0.05)mol/L? 0.10mol/L
所以c2=0.10mol/L
所以c2>c3;
60s后反应达平衡,反应混合物各组分的浓度不变,所以a=b.
故答案为:60;>;=
(2)由表可知,20s时,c(NO2?)=0.060mol/L,所以
? N2O4? 
? ?2 NO2,
浓度变化:0.03mol/L? 0.060mol/L
所以20s的四氧化二氮的浓度c1=0.1mol/L-0.03mol/L=0.07mol/L;
在0s~20s内四氧化二氮的平均反应速率为v(N2O4)=0.03mol/L20s=0.0015mol?(L?s)-1.
故答案为:0.07mol/L;0.0015mol?(L?s)-1.
(3)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L.
所以? N2O4? 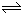
? ?2 NO2,
?0.1mol/L? 0.20mol/L
故答案为:0.20mol/L
本题解析:
本题难度:一般
5、选择题 下列现象不是由平衡移动引起的是
A.氯水光照颜色变浅
B.使用排饱和食盐水的方法收集氯气
C.H2、I2、HI平衡混合气加压颜色变深
D.重铬酸钾溶液中加碱颜色变为黄色
参考答案:C
本题解析:选项C中反应前后体积不变,加压平衡不移动,但碘的浓度增大,所以颜色加深,其余都是和平衡移动有关系的,答案选C。
本题难度:简单