时间:2025-06-26 02:55:18
1、选择题 下列离子中,核外有10个电子的是
A.Mg2+
B.S2-
C.K+
D.Cl-
参考答案:A
本题解析:对于原子,核外电子数等于质子数,阳离子是质子数减去电荷数,阴离子是质子数加电荷数,所以选项ABCD中的核外电子数分别是10、18、18、8,答案选A。
本题难度:简单
2、简答题 如图是周期表的一部分,已知A、B、C、D都是短周期元素,四种元素原子核外共有56个电子,推断A、B、C、D各是什么元素,写出他们的元素符号:A______,B______,C______,D______.
参考答案:A、B、C、D都是短周期元素,根据四种元素在周期表中的位置知,A位于第二周期,B、C、D位于第三周期,四种元素原子核外共有56个电子,即四种元素的原子序数为56,设C的原子序数为x,则B的原子序数是x-1,D的原子序数为x+1,A和C位于同一主族,A和C的原子序数相差8,则A的原子序数是x-8,四种元素的原子序数为56,所以得x-1+x+x+1+x-8=56,x=16,则C是S元素,B是P元素,D是Cl元素,A是O元素,
故答案为:O;P;S;Cl.
本题解析:
本题难度:一般
3、推断题 已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为?____________________。
(2)关于B2A2的下列说法中正确的是?________________。
A.B2A2中的所有原子都满足8电子结构?
B.每个B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子?
D.B2A2分子中的B-A键属于s—pσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是?________________。
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因____________
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中?Y含有_____________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相?等,则M的电子式为_____________?,N的结构式为______________。
(6)E的氢化物的价层电子对互斥理论模型为?_______,E?原子的杂化方式为?_________杂化。
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为____________,F原子配位数之比为_____________。 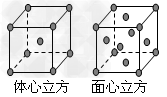
参考答案:(1)3d64s2;?
(2)CD
(3)直线型?
(4)C元素原子的最外层电子的p轨道处于半充满状态,能量低,较稳定,失去第一个电子需要的能量较B、D多?
(5)极性键、非极性键 ;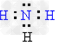 ?;
?;
(6)四面体形;sp3;?
(7)2b3:a3 ;3:2
本题解析:
本题难度:一般
4、推断题 已知A、B、C、D、E、F、G都是短周期的元素,它们的原子序数依次递增.A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,D与F同主族,G的原子半径是本周期元素中最小的.则:
(1)运送飞船的火箭燃料有一种液态化合物是由A、C元素组成的,已知该化合物的相对分子质量为32,其中氢元素的质量分数为12.5%.若该化合物与A2D2恰好完全反应,能产生两种无毒又不污染环境的物质,试写出该反应的化学方程式:___________________.
(2)C的原子间也可形成链状结构,假设C原子间只以单键形式连接,并与A形成系列化合物,则该系列化合物的通式为____________________________.
(3)由B和D以质量比为3∶8组成的化合物与E的同周期相邻主族元素的单质反应的化学方程式为________________________________________.
(4)G单质与E的最高价氧化物的水化物反应的离子方程式为_________________________.
参考答案:(1)N2H4+2H2O2===N2↑+4H2O
(2)NnHn+2
(3)2Mg+CO2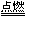 2MgO+C
2MgO+C
(4)Cl2+2OH-===H2O+Cl-+ClO-
本题解析:
本题难度:一般
5、选择题 下列性质的比较,错误的是( )
A.稳定性:HI<HBr<HCl<HF
B.酸性:H2SiO3<H3PO4<H2SO4<HClO4
C.原子半径:O<F<Na<Mg
D.最高正化合价:Si<P<S<Cl
参考答案:A.同主族元素从上到下元素的非金属性逐渐降低,则非金属性:F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,则稳定性:HI<HBr<HCl<HF,故A正确;
B.同周期元素从左到右元素的非金属性之间增强,则非金属性:Cl>S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:H2SiO3<H3PO4<H2SO4<HClO4,故B正确;
C.同周期元素从左到右原子半径逐渐减小,则原子半径:O>F;Na>Mg,原子核外电子层数越多,半径越大,则原子半径:Na>Mg>O>F,故C错误;
D.Si、P、S、Cl的最外层电子数分别为4、5、6、7,则最高化合价以此为+4、+5、+6、+7,故D正确.
故选C.
本题解析:
本题难度:简单