时间:2025-06-26 02:53:39
1、简答题 常温下,在32g水中溶解8g?CuSO4,恰好达到饱和,该溶液密度为1.21g/cm3,求:
①该溶液中CuSO4的物质的量浓度;
②取出20.0ml该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
参考答案:①8gCuSO4的物质的量为8g160g/mol=0.050mol,溶液的体积为:32g+8g?1210g/L?=0.033L,
故CuSO4的物质的量浓度为:0.050mol?0.033L=1.51?mol/?L,
答:CuSO4的物质的量浓度为1.51?mol/?L;
(3)取出溶液中含溶质硫酸铜的物质的量为:1.51?mol/?L×0.02L=0.0302mol,
故稀释后溶液的体积为0.0302mol1.00mol/L=0.0302L,即体积为30.2?ml.
答:稀释后溶液的体积是30ml.
本题解析:
本题难度:一般
2、选择题 下列溶液中,与100 ml 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是
A.100 ml 0.5 mol/L MgCl2溶液
B.200 ml 0.25 mol/L HCl溶液
C.50 ml 1 mol/L NaCl溶液
D.200 ml 0.25 mol/L CaCl2溶液
参考答案:D
本题解析:A Cl-的物质的量浓度是1.0mol/L;B Cl-的物质的量浓度是0.25 mol/L;C Cl-的物质的量浓度是1 mol/L;D Cl-的物质的量浓度是0.5 mol/L,故选D
考点:物质的量浓度的有关计算
本题难度:一般
3、选择题 将标准状况下a L HCl(g)溶于100g水中,得到的盐酸的密度为b g·cm-3,则该盐酸的物质的量浓度是
A.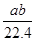 mol·L-1
mol·L-1
B.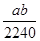 mol·L-1
mol·L-1
C.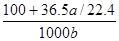 mol·L-1
mol·L-1
D.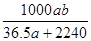 mol·L-1
mol·L-1
参考答案:D
本题解析:根据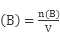 =
=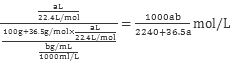 ,故D项正确。
,故D项正确。
考点:物质的量浓度计算。
本题难度:一般
4、选择题 只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是
| | ① | ② | ③ | ④ | ⑤ |
| 甲 | 物质粒子数 | 标准状况下气体摩尔体积 | 固体体积 | 溶质的质量分数 | 非标准状况下物质的质量 |
| 乙 | 阿伏加德罗常数 | 标准状况下气体体积 | 固体密度 | 溶液的体积 | 物质的摩尔质量 |
参考答案:C
本题解析:由n=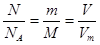 可知①②⑤正确。对③而言由固体体积和密度可求出固体的质量而不知摩尔质量,故无法求出n;对于④,n=cV(aq)=
可知①②⑤正确。对③而言由固体体积和密度可求出固体的质量而不知摩尔质量,故无法求出n;对于④,n=cV(aq)=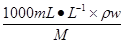 ×V(aq),因缺少溶液的密度和溶质的摩尔质量,无法求出n。
×V(aq),因缺少溶液的密度和溶质的摩尔质量,无法求出n。
本题难度:一般
5、选择题 已知14mol/L的H2SO4溶液的溶质质量分数为80%,那么7mol/L的H2SO4溶液的溶质量分数将( )
A.大于40%
B.等于40%
C.小于40%
D.无法确定
参考答案:A
本题解析:设14mol/L的H2SO4溶液的密度为ρ1,7mol/L的H2SO4溶液的密度为ρ2,质量分数为w2,根据c=1000ρw/M,则有14=1000ρ1×80%/M, 7=1000ρ2w2/M,则有:ρ2w2/(ρ1×80%)=1/2,w2=40%ρ1/ρ2,硫酸密度大于水,浓度越大,密度越大,则ρ1>ρ2,所以w2>40%,故A项正确。
考点:本题考查物质的量浓度与质量分数的相关计算。
本题难度:一般