时间:2025-06-26 02:53:39
1、选择题 室温下,将amol钠和amol铝一同放入mg水(足量)中,所得溶液的密度为dg/mL,下列说法正确的是
A.该溶液的物质的量浓度: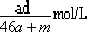
B.所得气体体积为44.8aL
C.该溶液的质量分数: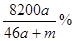
D.向溶液中通入过量CO2,未见白色沉淀
参考答案:C
本题解析:amol钠溶于水生成amol氢氧化钠和0.5amol氢气,生成的氢氧化钠恰好与铝反应生成amol偏铝酸钠和1.5amol氢气,因此生成的氢气总共是2amol,但体积不一定是44.8aL,B不正确;偏铝酸钠吸收CO2生成氢氧化铝沉淀,D不正确;反应后溶液的质量是23a+27a+m-4a=(46a+m)g,溶液的体积是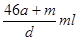 ,所以A不正确;溶质是偏铝酸钠,质量是82ag,所以选项C正确,答案选C。
,所以A不正确;溶质是偏铝酸钠,质量是82ag,所以选项C正确,答案选C。
本题难度:一般
2、选择题 下列叙述正确的是(?)。
A.1 mol H2O的质量为18 g/mol
B.CH4的摩尔质量为16 g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4 L
参考答案:C
本题解析:质量的单位是g,摩尔质量是g/mol,所以A、B都不正确。根据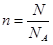 可知,3.01×1023个SO2分子是0.5mol,其质量是0.5mol×64g/mol=32g,C正确。气体摩尔体积只能适用于气体,所以D不正确,答案选C。
可知,3.01×1023个SO2分子是0.5mol,其质量是0.5mol×64g/mol=32g,C正确。气体摩尔体积只能适用于气体,所以D不正确,答案选C。
本题难度:一般
3、选择题 NA表示阿伏加德罗常数,下列说法正确的是(?)
A.标准状况下11.2L的水中含有0.5个NA水分子
B.含1 mol HCl的盐酸中离子总数为NA个
C.1 mol H2和O2的混合气体中含NA个分子
D.1 mol大米中含有NA个大米粒子
参考答案:C
本题解析:A错,标准状况下水为冰水混合物;B错,含1 mol HCl的盐酸中离子总数为2NA个;C正确;D错,物质的量用于表示含有一定数目的微观粒子集合体,不是宏观物质;
本题难度:一般
4、选择题 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为( )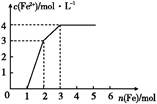
A.1∶1∶1
B.1∶3∶1
C.3∶3∶8
D.1∶1∶4
参考答案:D
本题解析:氧化性由强到弱的顺序为:HNO3>Fe3+>Cu2+,则随铁粉增加,反应分别为:
4HNO3(稀)+Fe Fe(NO3)3+NO↑+2H2O
Fe(NO3)3+NO↑+2H2O
2Fe(NO3)3+Fe 3Fe(NO3)2
3Fe(NO3)2
Cu(NO3)2+Fe Fe(NO3)2+Cu
Fe(NO3)2+Cu
所以原溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量之比为:(2-1)∶1∶4=1∶1∶4。
本题难度:一般
5、选择题 已知硫、二氧化硫、三氧化硫三种物质的质量比为2:4:5,它们的物质的量之比为
A.2:4:5
B.1:1:1
C.5:4:2
D.1:2:3
参考答案:B
本题解析:可以假设它们的质量分别是2x、4x、5x,根据公式n=m/M计算,n(S)="2x/32=" x/16
n(SO2)="4x/64=" x/16,n(SO3)="5x/80=" x/16,得出物质的量相等,选B。
考点:物质的量的计算。
本题难度:一般