时间:2025-06-26 02:51:12
1、选择题 将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体,待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是 ( ) 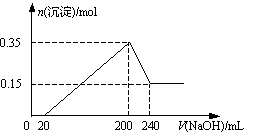 ?
?
A.Mg和Al的总质量为8 g
B.硫酸的物质的量浓度为5 mol/L
C.NaOH溶液的物质的量浓度为5 mol/L
D.生成的H2在标准状况下的体积为11.2 L
参考答案:C
本题解析:镁、铝分别与稀硫酸反应生成硫酸镁、硫酸铝以及氢气。根据图像可知,加入氢氧化钠溶液后并没有立即生成白色沉淀,这说明稀硫酸的是过量的。即氢氧化钠首先和过量的稀硫酸反应,然后在分别与硫酸镁、硫酸铝反应生成氢氧化镁、氢氧化铝沉淀。当氢氧化钠溶液过量时,氢氧化铝又溶解在氢氧化钠溶液中,生成偏铝酸钠和水。根据图像可知,与氢氧化铝反应的氢氧化钠水240ml-200mol=40ml。而沉淀减少了0.35mol-0.15mol=0.20mol,这说明氢氧化铝是0.2mol,氢氧化镁是0.15mol,所以镁和铝的总的质量是0.15mol×24g/mol+0.2mol×27g/mol=9g,和稀硫酸反应生成的氢气是0.3mol+0.15mol=0.45mol,标准状况下的体积是10.08L。根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,氢氧化钠的物质的量浓度是0.2mol÷0.04L=5.0mol/L。则沉淀最大值是生成硫酸钠是(0.2L×5mol/L)÷2=0.5mol,所以稀硫酸的浓度是0.5mol÷0.5L=1.0mol/L,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力培养与解题方法的指导与训练。该题的关键是明确反应的原理,然后再结合图像灵活运用即可,有利于培养学生的逻辑推理能力。
本题难度:简单
2、选择题 用铝热法还原下列氧化物制得金属各1 mol,消耗铝最少的是
A.MnO2
B.WO3
C.Cr2O3
D.Co3O4
参考答案:D
本题解析:用铝热法还原金属氧化物时,Al作还原剂,金属氧化物作氧化剂。在反应中金属氧化物被还原为单质,显然,在氧化物中金属化合价越高,变为单质时需获得的电子越多,消耗铝越多;金属化合价越低,得电子数越少,消耗铝越少。以上金属氧化物中金属的化合价分别为:Mn(+4)、W(+6)、Cr(+3)、Co(+)。Co化合价最低,耗铝最少。答案选D。
本题难度:简单
3、实验题 Ⅰ.将刮去氧化膜的镁片投入沸水中,反应的化学方程式为 。
Ⅱ.若用灼热的镁粉与水蒸气反应,则在生成H2的同时还可能得到氧化镁粉未。为实现这一反应并收集一瓶H2,某课外活动小组设计了如图所示的装置。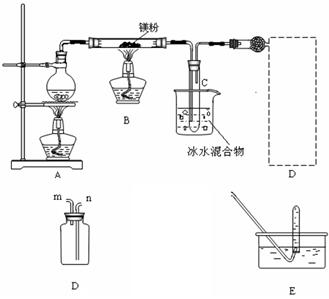
(1)实验开始时,应先点燃 (填“A”或“B”)处的酒精灯, 等观察到 ,再点燃另一酒精灯。这样做的目的是 。
等观察到 ,再点燃另一酒精灯。这样做的目的是 。
(2)若将装置D与干燥管相连,则所连导管口应为 (填“m”或“n”),这种方法叫 (填“向上”、“向下”)排气法
(3)小试管C的作用是 。
(4)装置E的作用是检验集气瓶中是否收集满了H2,则检验的操作和需要观察的现象是 。
(5)反 应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能M
应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能M g和Mg(OH)2?任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
g和Mg(OH)2?任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
参考答案:ⅠMg + 2H2O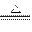 Mg(OH)2 + H2↑
Mg(OH)2 + H2↑
Ⅱ(1)A;蒸馏水沸腾后;排净空气与Mg发生反应
(2)m 向下
(3)冷凝水蒸气
(4)将E装置与D装置相连,收集一试管导出的气体,并将试管移近酒精灯火焰,观察爆鸣声的大小。
(5)取少许反应后的固体产物,投入稀硫酸中(或稀盐酸)中,若有气泡产生,说明镁粉有残留(其它合理解答也可 )。
)。
本题解析:略
本题难度:一般
4、选择题 美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.原子半径:Na<Al
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
D.若m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小
参考答案:AD
本题解析:同周期元素原子半径随原子序数的递增而逐渐减小,故A错误;相同质量的Al提供的电子多于相同质量的Na,故D错误。
本题难度:一般
5、选择题 铝制器皿能够盛放的物质是( )
A.KOH溶液
B.浓硫酸
C.NaOH溶液
D.稀硫酸
参考答案:A、铝与氢氧化钾溶液反应生成偏铝酸钾与氢气,不能用铝制品容器盛放,故A错误;
B、浓硫酸是强氧化性的酸,铝在浓硫酸中发生钝化现象,故铝制品容器可以盛放浓硫酸,故B正确;
C、铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,不能用铝制品容器盛放,故C错误;
D、稀硫酸有弱氧化性,能和铝反应生成氢气,不能用铝制品容器盛放,故D错误;
故选B.
本题解析:
本题难度:简单