时间:2025-06-26 02:51:12
1、填空题 某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: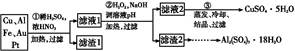
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为 ?。?
(2)第②步加H2O2的作用是 ?;?
调溶液pH的目的是使 生成沉淀。?
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。?
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
上述三种方案中, 方案不可行,原因是 ? ;?
从原子利用率角度考虑, 方案更合理。?
(5)探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2- CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ?;?
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ?;?
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 ?。?
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
2、选择题 镁条在空气中燃烧后,其生成物中可能含有的物质是( ? )
A.MgCO3、MgO、Mg3N2
B.Mg(OH)2、MgO、MgCO3
C.MgO、Mg3N2、C
D.Mg2N3、C、MgO
3、填空题 (10分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: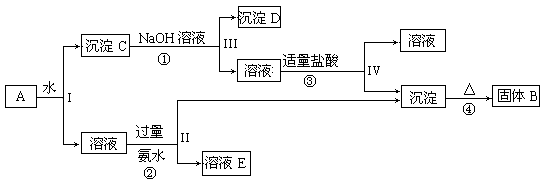
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是?。
(2)写出①、②、③离子方程式④化学反应方程式
①?;②?;
③?;④?。
4、填空题 某同学欲检验抗酸药中是否含有Al(OH)3,操作如下:取药剂3-4片研碎,向样品中加入过量的盐酸,过滤,得澄清溶液,向澄清溶液中滴加NaOH溶液,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中是否含有Al(OH)3____(填“含”或“不含”),请写出有关反应的化学方程式:①Al(OH)3+3HCl=AlCl3+3H2O;②________________;③________________。
5、选择题 下列物质中,既能与盐酸又能与NaOH溶液反应的是
A.氢氧化铝
B.硅酸钠
C.碳酸钠
D.二氧化硅