时间:2025-06-26 02:49:35
1、选择题 “84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用,它的有效成分是下列物质的一种,这种物质是
A.NaOH
B.NaClO
C.KMnO4
D.Na2O2
2、选择题 将新制氯水分别滴加到AgNO3溶液、加有酚酞的NaOH溶液、石蕊溶液、品红溶液和Na2CO3溶液中至过量,依次观察到的现象描述合理的一组是( )
A.产生沉淀、无明显变化、变红、溶液褪色、有气泡
B.无明显变化、溶液褪色、变红、无明显变化、产生沉淀
C.产生沉淀、溶液褪色、先变红后褪色、溶液褪色、有气泡
D.产生沉淀、无明显变化、先变红后褪色、无明显变化、产生沉淀
3、选择题 硅作为一种新型能源被广泛开发利用,关于其有利因素下列说法中,你认为不正确的是( )
A.硅燃烧产物对环境产生的污染,容易得到有效控制
B.从Si(s)+O2(g)  SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
C.自然界中硅的贮存量丰富,可以从自然界直接获得单质硅
D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一
4、选择题 下列物质既能通过与Cl2化合反应制取,也能通过与盐酸反应制取的是
A.CuCl2
B.FeCl2
C.FeCl3
D.ZnCl2
5、填空题 (15分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。2001年我国卫生部规定,饮用水中ClO2—的含量应不超过0.2mg·L-1。
饮用水中CIO2、CIO2—的含量可用连续碘量法进行测定。CIO2被I—还原为CIO2—、Cl—的转化率与溶液pH的关系如下图所示。当pH≤2.0时,CIO2—也能被I—完全还原成Cl—。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2==Na2S4O6+2NaI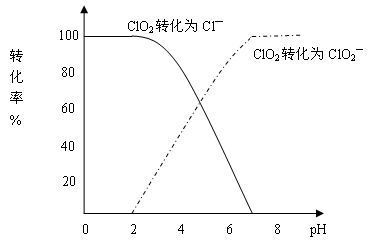
①请写出pH≤2.0时,CIO2—与I—反应的离子方程式 ? 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的K I晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: ? 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根⑤据你现有的知识,写出步骤4滴定至终点的现象判断依据为?
④根据上述分析数据,测得该饮用水样中CIO2—的浓度为 ? mol·L-1(用含字母的代数式表示。)
⑤若饮用水中ClO2— 的含量超标,可向其中加入适量的Fe2+将ClO2— 还原成Cl—-, 请猜测该反应的氧化产物是?(填化学式)。